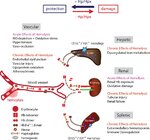
Das mikrosomale HO ist das geschwindigkeitsbestimmende Enzym beim Abbau von Häm und spielt eine Schlüsselrolle beim Schutz von Zellen vor häminduziertem oxidativem Stress. Es zerlegt das prooxidative Häm in das antioxidative Biliverdin, den Vasodilator Kohlenmonoxid (CO) und Eisen. Biliverdin wird dann durch das Enzym Biliverdin-Reduktase zu Bilirubin reduziert. Bisher wurden drei Isoformen von HO identifiziert: HO-1, HO-2 und HO-3. HO-1 ist hochinduzierbar durch eine Vielzahl von Reizen, einschließlich oxidativem Stress, Hitzeschock, Hypoxie, Schwermetallen, Ischämie-Reperfusion, Zytokinen und seinem Substrat Häm. Das konstitutiv exprimierte HO-2 nimmt am normalen Häm-Einfangen und -Metabolismus teil, während die Funktion von HO-3 noch immer untersucht wird. HO-1 spielt eine entscheidende Rolle bei der Regulierung der Hämdegration und schützt vor Häm-vermittelten oxidativen Verletzungen.
HO-1 kann die schädlichen Wirkungen von Fresenhäm durch verschiedene Mechanismen verhindern. Diese umfassen die Hemmung (a) der Freisetzung von freiem Häm aus Hämoproteinen, (b) die Akkumulation von freiem Häm in Zellen und / oder (c) die prooxidative Wirkung von freiem Häm. HO-1 kann die Freisetzung von Häm aus Hämoprotein verhindern, indem CO, ein Endprodukt des Häm-Abbaus, erzeugt wird. Sobald es an die Hämgruppen von Hämoproteinen gebunden ist, inhibiert CO die Hämeisenoxidation, wodurch die Oxidation von Hämoproteinen begrenzt und die Freisetzung von Häm verhindert wird. Es wurde kürzlich gezeigt, dass HO-1 durch diesen Mechanismus die Akkumulation von freiem Häm im Plasma nach einer Plasmodium-Infektion hemmt und somit das Auftreten schwerer Malaria bei Mäusen verhindert.
Die Analyse von HO-1-Null-Mäusen hat gezeigt, dass sich diese Tiere akkumuliert haben, mit Alters-, Leber- und Niereneisen, die zu oxidativer Schädigung, Gewebeverletzung und chronischer Entzündung beigetragen haben. Auf der anderen Seite zeigten HO-1-Null-Mäuse ein niedriges Serum-Eisen-Konzentrat und entwickelten eine Anämie . Diese Daten zeigten, dass, obwohl HO-1 ein stressinduziertes Protein ist, es unter basalen Bedingungen wichtig ist, Leber und Niere vor oxidativen Schäden zu schützen und dass es ein essentieller Regulator des Eisenstoffwechsels und der Homöostase ist. Die Überexpression von HO-1 ist mit der Auflösung der Entzündung durch die Erzeugung von nützlichen Molekülen wie CO, Bilirubin und Ferritin verbunden, die aus dem Katabolismus von toxischem Häm resultieren. Einige der Endprodukte des Hämkatabolismus durch HO-1 könnten die prooxidative Wirkung von freiem Häm verhindern. Dies ist wahrscheinlich der Fall für Biliverdin, das selbst antioxidative Eigenschaften hat, aber zusätzlich durch Biliverdin-Reduktase in das potente lipidlösliche Antioxidans Bilirubin umgewandelt werden kann.
Der Hämkatabolismus von HO-1 sollte auch die Akkumulation von freiem Häm in Zellen verhindern. Dieser zytoprotektive Mechanismus muss jedoch mit der Induktion der Ferritin (Ft) -Expression gekoppelt sein, um die prooxidative Wirkung von labilem Eisen, das über Hämkatabolismus produziert wird, zu vermeiden. Diese Vorstellung steht im Einklang mit der Beobachtung, dass die Überexpression von Ft die zytoprotektive Wirkung von HO-1 nachahmen kann. Ft ist das wichtigste intrazelluläre Depot von nicht-metabolischem Eisen und wirkt als Häm-Entgiftungssystem, indem es freies Eisen abfängt und die Zellen vor den negativen Auswirkungen schützt. Ft ist ein multimeres Protein, das aus 24 Untereinheiten von zwei Arten besteht, der schweren Kette (H-Ft) und der leichten Kette (L-Ft) und hat eine sehr hohe Speicherkapazität für Eisen (bis zu 4500 mol Eisen pro mol Ft). In der Ft-Schale hängt der Anteil an schweren und leichten Untereinheiten vom Eisenstatus der Zelle oder des Gewebes ab und variiert zwischen Organen und Spezies. H-Ft zeigt eine Ferroxidase-Aktivität, die die Oxidation von Eisen (II) zu Eisen (III) katalysiert, um eine intrazelluläre Speicherung von Eisen in L-Ft zu ermöglichen, das als intrazelluläre Eisenlagerstätte fungiert.
Es wurde gezeigt, dass Eisen, das während des Hämkatabolismus freigesetzt wird, schnell in Ft gespeichert wird. Zusammen erlauben HO und Ft eine schnelle Eisenverschiebung von Häm zu Ft-Kern, wo Eisen weniger zur Verfügung steht, um schädliche Reaktionen zu katalysieren. Ihre starke antioxidative Rolle. Durch Erhöhung der Expression von HO-1 und Ft können Zellen letalem Häm-induziertem oxidativem Stress überleben. Interessanterweise zeigten In-vivo-Arbeiten, dass Hx-null-Mäuse Ft in der Leber nach Häm-Überladung nicht hochregulieren konnten, was zeigt, dass der Mangel an Hx die Fähigkeit der Leber zur Erholung von Häm-Eisen unter Häm-Überlastungs-Konditionierung verringert . Umgekehrt weist eine Hochregulierung von Ft in der Wildtyp-Leber auf eine starke Eisenentgiftungskapazität und eine aktive Eisenspeicherung hin und zeigt erneut, dass Hx Crucium ist, um die Hämabgabe an Hepatozyten zu vermitteln.
Haptoglobin and Hemopexin in Heme Detoxification and Iron Recycling