Funktion der Antigene von C. albicans und Beeinflussung des Immunsystems
C. albicans besitzt eine Vielzahl von zytoplasmatischen wie auch zellwandgebundenen Antigenen, die unterschiedliche Immunantworten provozieren. Ergebnis: Es werden vermehrt Antikörper der Klassen A, G und M gebildet. Mit Antikörpern beladene Hefezellen werden besser als Zellen ohne Beladung phagozytiert. Ganz wesentlich bei der zellulären Abwehr sind neben Monozyten und Makrophagen polymorphkernige Granulozyten, die Hyphen von Candida albicans zerstören sowie Blastosporen phagozytieren können. Die Stimulation von Granulozyten wird besonders durch IFN-gamma gesteuert.
Neben den zellassoziierten Antigenen werden auch wasserlösliche Antigene abgegeben, die als Allergene wirken können. Offensichtlich besteht ein Zusammenhang zwischen der Besiedlung des Gastrointestinaltrakts mit C. albicans und Asthma, Rhinitis sowie atopischer Dermatitis mit entsprechender IgE-Bildung.
Der Schlüssel für die unterschiedliche Reaktion des Menschen gegenüber einer C. albicans-Besiedlung könnte daher an dem Punkt „Allergie" zu finden sein. Eine Invasion in tiefe Gewebeschichten –wie sie auch nur selten nachzuweisen ist – ist in der Pathogenese daher nicht notwendig! Der pathogenetische Weg „Allergie" würde auch erklären, weshalb nur ein Teil der Personen mit C. albicans im Gastrointestinaltrakt Symptome zeigt und auch schon niedrige Keimzahlen eine Reaktion des Immunsystems provozieren.
Modell der Pathogenese
Eine gesteigerte Kohlenhydratzufuhr führt bei Personen mit C. albicans im Darm:
1. zu einer erhöhten Expression von Integrinen und damit zu einer Zunahme der C. albicans-Zellen an der Schleimhaut (sowohl im Dünn- als auch im Dickdarm). Sie fördert
2. durch ein saures Milieu die Aktivität saurer Proteinasen. Gleichzeitig steigt
3. durch die zunehmende Zellzahl die Wahrscheinlichkeit eines „switching":
– Virulenzfaktoren werden exprimiert,
– lokal kann es zur Auflockerung des Epithelzellverbandes kommen,
– Hefezellen dringen in das Epithel bis zur Basalmembran vor.
Antigene der Zelloberfläche sowie wasserlösliche Antigene gelangen dabei in die Nähe der M-Zellen in den Krypten der Darmschleimhaut, die Kontakt zu Makrophagen und T-Lymphozyten in der Submukosa haben.
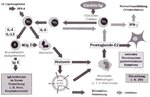
Hat ein erster Kontakt der Hefezelle mit dem Immunsystem stattgefunden, tritt nach der Phase der Epithelinvasion – bei immunkompetenten Personen bleibt das Geschehen auf diese anatomische Struktur begrenzt – die Phase immunologischer Veränderungen ein. In einigen experimentellen Mäusemodellen hängt der klinische Verlauf einer Candida-albicans-Infektion von der Qualität der T-Zell-vermittelten Immunantwort ab. CD4+-T-Helferlymphozyten (TH-Zellen) können in zwei Subpopulationen unterteilt werden, TH1 und TH2. Die TH1-Population produziert IL-2 sowie INF-(a. Dies führt zur verzögerten Hyperimmunität, während die TH2- Population für IL-4 und IL-5 mit nachfolgender antigenspezifischer Immunglobulinsynthese zuständig ist. Eine TH1-Antwort ist mit einer protektiven Immunität assoziiert, während bei einer TH2- Antwort ein Schutz fehlt.
Unter dem Einfluß von Candida-Antigen wird im ungünstigen Fall die Th-Zellpopulation (Th = T-Helferzellen, C4+) in Richtung Th2- Subpopulation verschoben. Th2-Lymphozyten wiederum bilden Interleukine, welche den Isotyp-Wechsel der B-Zelle in Richtung IgE und IgG1 steuern (IL-4, IL-13) sowie die Proliferation von Mastzellen anregen (IL-9).
Bei Personen mit einer genetisch veränderten alpha-Untereinheit des IL-4 Rezeptors der B-Zellen (bei Hyper-lgE-Syndrom, bei schwerer atopischer Dermatitis, bei Patienten mit Atopie) wird IL-4 verlängert gebunden. Daraus resultiert eine Signalverstärkung, durch die vermehrt IgE gebildet wird. Nicht jede Person reagiert daher –bedingt durch genetische Faktoren – in der gleichen Weise oder in gleicher Intensität auf eine intestinale C. albicans-Besiedlung.
Die Reaktion des IgE mit Mastzellen kann im folgenden Schritt eine Degranulation der Mastzellen auslösen. Dabei werden Histamin (Hypersensitivität vom Soforttyp) und außerdem 5-HydroxyTryptamin (5-HT) freigesetzt. Durch diese Stimulation wiederum produzieren Makrophagen vermehrt Prostaglandin E2 (PGE2). Dieses beeinflußt das enterale Nervensystem und reguliert die Th 1 - Lymphozytensubpopulation herunter.
Dieser Mechanismus erklärt die intestinale Symptomatik wie Bauchkrämpfe oder eine vermehrte Darmmotilität. 5-HT aktiviert ebenfalls die entsprechenden Rezeptoren afferenter Neuronen des Nervus vagus, die mit dem Hirnstamm in Verbindung stehen. Nach neueren Daten kommt dem enteralen Nervensystem mit seinen engen Verbindungen zu anderen Teilen des Nervensystems und Organen wie Gallenblase oder Pankreas in der Pathogenese vieler Erkrankungen eine weit größere Rolle zu, als in der Vergangenheit angenommen wurde. Wie stark C. albicans das Intestinum beeinflussen kann, zeigt das Krankheitsbild der neutropenischen Enterokolitis. Es ist eine wichtige Ursache der Morbidität und Letalität bei neutropenischen Patienten. Die klinische Diagnose beruht auf den Symptomen Fieber, Diarrhoe (wenigstens vier Stühle pro Tag), abdominalen Schmerzen und Peritonealreizung zusammen mit wenigstens einem weiteren der folgenden Symptome:
– Ileus mit geblähtem Abdomen zusammen mit veränderten Darmgeräuschen und geweiteten Darmschlingen im Ultraschall bzw. in der Röntgenübersicht;
– nekrotisierende Kolitis mit Verdickung der Darmwand über sieben Millimeter (im CT oder Echo) und (oder) Pneumatosis intestinalis;
– Blutung des unteren Gastrointestinaltraktes mit Transfusionsbedarf.
In einer Untersuchung an 20 Patienten konnten bei 15 Patienten Candida spp., davon zehnmal C.-albicans-Stämme im Stuhl isoliert werden. Bei zwölf Patienten mit positivem Candida-Nachweis war im Blut auch Candida-Mannan zu finden, Blutkulturen waren jedoch negativ!
Candida spp. scheint nach vorliegenden Daten eine wichtige (Ko-) Ursache der neutropenischen Enterokolitis zu sein, da bei elf von zwölf Patienten die antimykotische Therapie (Fluconazol, Amphotericin B) zum Rückgang des Fiebers und einer Besserung der klinischen Symptome führte. Offensichtlich handelt es sich bei der neutropenischen Enterokolitis um ein nicht-invasives Geschehen, da C. albicans nicht im Blut nachgewiesen werden kann. Eine entzündliche Auflockerung des Darmepithels führt zum Durchtritt von Zellwandbestandteilen (Mann-an) ins Blut, eine allergische Komponente trägt zur klinischen Symptomatik mit Diarrhoe und abdominalen Schmerzen bei.
Neben der Allergisierung vom Typ I, wie sie bei Asthma, allergischer Rhinitis usw. typisch ist, weisen neue Daten auch auf eine zelluläre allergische Komponente hin. Werden Lymphozyten entsprechender Individuen mit C. albicans-Antigen stimuliert, steigt der Stimulationsindex im FACS an. Bei höheren Verdünnungen nimmt interessanterweise der Stimulationsindex nicht linear, sondern diskontinuierlich ab. Auch dies ist ein wichtiger Hinweis darauf, daß keine lineare Beziehung zwischen Zellzahl und allergischer Reaktion besteht.