Themenstarter
- Beitritt
- 10.01.04
- Beiträge
- 72.835
Das Dt. Zentrum für Infektionsforschung schreibt:
 www.dzif.de
www.dzif.de
Auf dieser Seite finden sich einige Artikel, die auch mit dem Thema „Biofilm“ zu tun haben, u.a.:
Hier werden Möglichkeiten genannt, gegen die Biofilm anzugehen:

 www.scinexx.de
www.scinexx.de
Mehr zum Manuka-Honig:
 www.bee-careful.com
www.bee-careful.com
 bienen.info
Anscheinend wird auf der Welt wesentlich mehr Manuka-Honig verkauft als produziert werden kann. Insofern muß man sich eine vertrauenswürdige Quelle dafür suchen, damit man nicht betrogen wird.
bienen.info
Anscheinend wird auf der Welt wesentlich mehr Manuka-Honig verkauft als produziert werden kann. Insofern muß man sich eine vertrauenswürdige Quelle dafür suchen, damit man nicht betrogen wird.
Auch andere Honigsorten scheinen dem Manuka-Honig ähnlich und ebenbürtig:
 www.aroma-delikatessen.de
www.aroma-delikatessen.de
Angeblich gibt es auch dt. ökologische Honigsorten , die dem Manuka-Honig entsprechen.
Grüsse,
Oregano
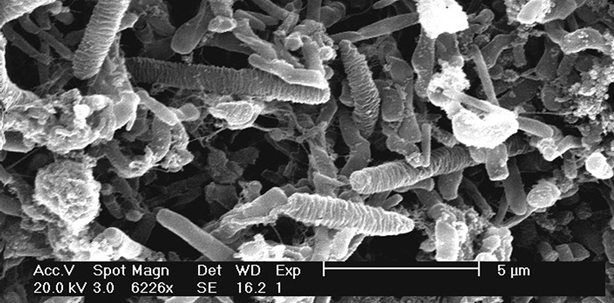
...Als Biofilm bezeichnet man Schleimschichten, die von Mikroorganismen gebildet werden, die selbst in diese Schleimschicht eingebettet sind. Bakterien, die Biofilme bilden, stellen ein medizinisches Problem dar.
Die schleimige Schicht besteht aus Zuckern und Proteinen. Sie schützt die darin eingebetteten Bakterien vor dem Immunsystem und macht sie unempfindlicher gegen Antibiotika. Die Bakterien bilden auf Oberflächen wie Zähnen oder medizinischen Implantaten regelrechte Gemeinschaften, die miteinander kommunizieren. Medizinisch relevante Erreger, die Biofilme bilden, sind Staphylokokken, Pseudomonaden und Streptokokken. ...
Biofilm | Deutsches Zentrum für Infektionsforschung
Als Biofilm bezeichnet man Schleimschichten, die von Mikroorganismen gebildet werden, die selbst in diese Schleimschicht eingebettet sind. Bakterien, die Biofilme bilden, stellen ein medizinisches Problem dar.
Auf dieser Seite finden sich einige Artikel, die auch mit dem Thema „Biofilm“ zu tun haben, u.a.:
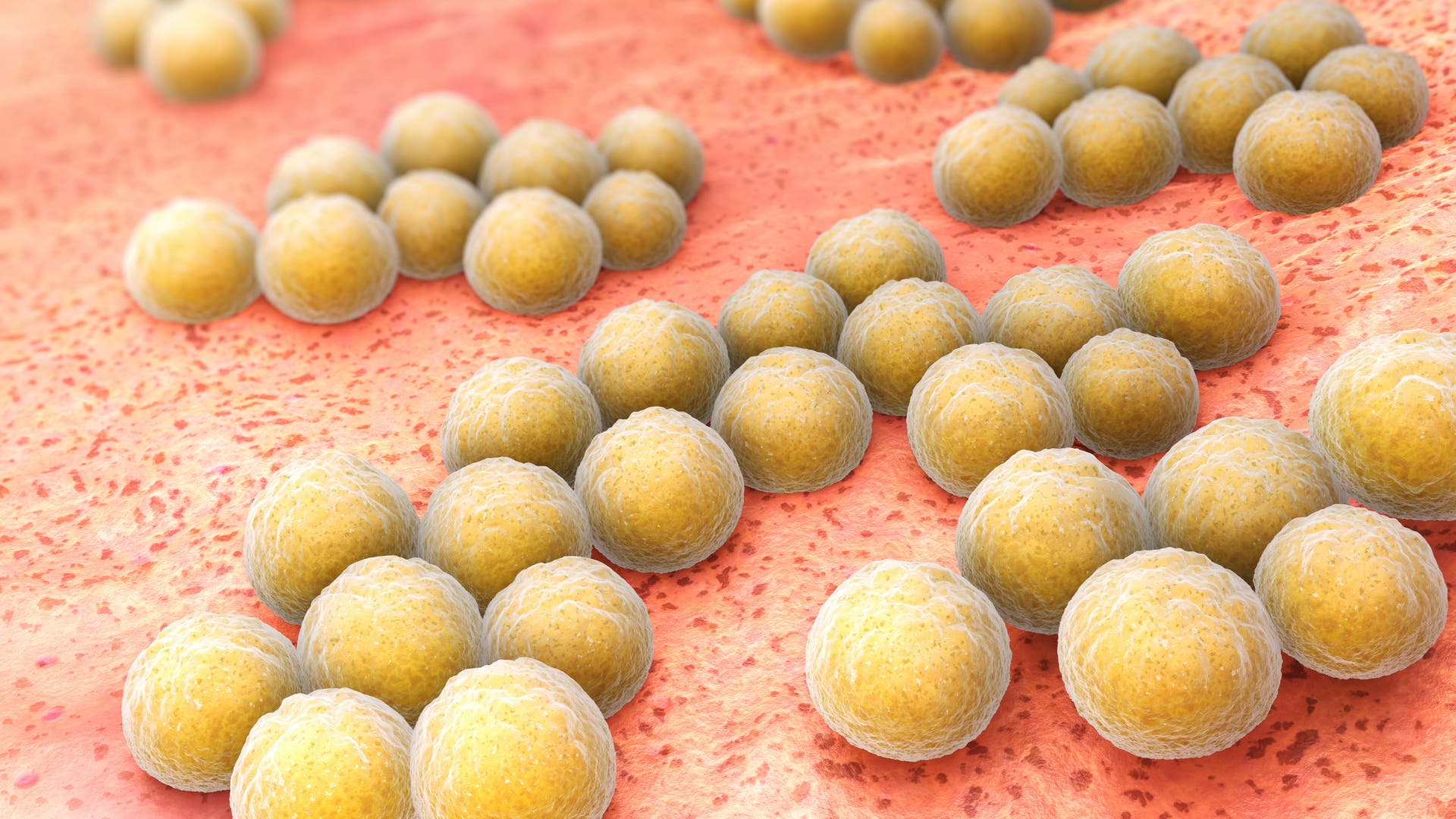
... Im Fokus der Gruppe um Alexander Titz steht der Biofilm, eine Art Schleimschicht, die den Bakterien als physikalischer Schutz gegenüber dem Immunsystem und gegenüber Antibiotika dient. Pseudomonas aeruginosa, ein gefürchteter Krankenhauskeim, gehört beispielsweise zu den Bakterien, die sich im Biofilm vor einem Angriff von Antibiotika schützen können und zunehmend Resistenzen entwickeln. ...
... Biofilme von Bakterien zu knacken und die Krankheitserreger damit aus der Reserve zu locken – eines der Ziele, die der Chemiker Dr. Alexander Titz verfolgt. Der Nachwuchsgruppenleiter am Helmholtz-Institut für Pharmazeutische Forschung in Saarbrücken (HIPS) entwickelt Substanzen, die den bakteriellen Schutzwall angreifen können. Zu den aussichtsreichen Kandidaten gehören seine chemisch modifizierten Zuckermoleküle. Wir wollten mehr wissen und haben den DZIF-Forscher im neu erbauten HIPS besucht. ...
... Bakterien der Art Pseudomonas aeruginosa gehören zu den Krankenhauskeimen und sind gegen viele gängige Antibiotika resistent. Sie können alle Organe oder auch Implantate befallen und sogenannte Biofilme bilden, in denen sie lange Zeit geschützt überdauern. Die Folge ist eine chronische Infektion, die nur schwer behandelt werden kann, da sowohl das Immunsystem als auch Antibiotika den Bakterien nichts anhaben können. Um einen Biofilm zu bilden, setzen die Pseudomonaden bestimmte Proteine frei – die Lektine. Diese Proteine binden außerhalb der Bakterienzellen an Zuckermoleküle und vernetzen sie zu einer Matrix, in der sich die Erreger zusammenlagern. Gelänge es, die Lektine mit einem Wirkstoff zu blockieren, könnten so bestehende Biofilme aufgelöst oder deren Bildung verhindert werden. ...
... „Die Lektine sind Proteinmoleküle, die die Bestandteile des Biofilms miteinander vernetzen können - sozusagen der Zement in der Mauer“, sagt Dr. Alexander Titz, Leiter einer DZIF-Nachwuchsgruppe am HIPS in Saarbrücken. „Die Lektine können an mehreren Stellen Zuckermoleküle wie Mannose oder Galaktose, die sich auf den Oberflächen der Bakterien und den Wirtszellen befinden, binden und diese dann verknüpfen.“ Diese Zuckermoleküle wollen sich die Forscher nun zunutze machen und sie chemisch so manipulieren, dass sie zu Lektin-Inhibitoren werden. „Gelingt es uns, die Funktion der Lektine chemisch zu stören, verlieren die Bestandteile des Biofilms ihren Halt. ...
Hier werden Möglichkeiten genannt, gegen die Biofilm anzugehen:
... Auch wenn bereits ein Befall mit mikrobiellen Biofilmen vorliegt, können Mittel gegen sie eingesetzt werden. So zum Beispiel Phagen – Viren, die Bakterien angreifen und auflösen. Sie besitzen eine hohe Wirtsspezifität, können also gezielt gegen bestimmte Mikroben eingesetzt werden und befallen auch inaktive Zellen, sodass die für wiederkehrende Infektionen verantwortlichen Persister ebenfalls zerstört werden.
...
Eine andere Möglichkeit bestehende Biofilme zu zerstören, haben Forscher um Xinpei Lu von der Huazhong Universität in Wuhan entdeckt. Sie nutzten kalte Plasmen mit geringem Ionisationsgrad, die meist durch Laserpulse aus Gas mit niedrigem Druck erzeugt werden. Wenn die energiereichen Elektronen dieses Plasmas auf die Moleküle der Umgebungsluft treffen, ionisieren sie diese zum Teil und produzieren hochreaktive neue Verbindungen wie Hydroxyl-Ionen. Pro Kubikzentimeter kann ein Plasma Milliarden solcher freier Radikale erzeugen. Damit können selbst Krankheitserreger in hartnäckigen Biofilmen abgetötet werden, gegen die gängige Methoden kaum helfen.
...
Einen weiteren Ansatzpunkt bildet die extrazelluläre Matrix der Biofilme. Wird sie zerstört, fällt der wichtigste Schutz der Bakterien weg. Eine Möglichkeit dafür ist der Einsatz spezieller Enzyme.
Das aus Actinobacillus actinomycetemcomitans stammende Dispersin B ist ein Enzym, das eine in bestimmten Bakterien-Biofilmen vorkommende Matrix-Komponente spaltet und Biofilme sowohl in vivo als auch in vitro auflösen kann. Der In-vivo-Einsatz von Enzymen ist jedoch durch potenzielle Immunreaktionen nicht immer möglich.
Auch die Lektine zu zerstören, die den Bakterien im Biofilm Zusammenhalt sichern, könnte wirksam sein. „Lektine vernetzen die Bestandteile des Biofilms“, erklärt Alexander Titz ...
...
Neben diesen meist bereits vielversprechenden Methoden, haben Forscher um Wook Chang von der Nanyang Technological University in Singapur noch eine weitere, ungewöhnliche Strategie gegen Biofilme entwickelt: Sie bauten harmlose Darmbakterien genetisch so um, dass diese Jagd auf tödliche Keime der Art Pseudomonas aeruginosa machten.
Sensoren und Waffen des manipulierten „Helfers“ konstruierten die Forscher dabei mit Hilfe gentechnischer Methoden komplett neu und pflanzten diese dann in die Darmbakterien als Träger ein. Im Laborversuch erwiesen sich diese künstlich erzeugten „Killerbakterien“ als extrem effektiv und wirksam gegenüber den resistenten Keimen und Biofilmen.
...
Eine weitere eher erstaunliche Waffe gegen Biofilme ist eine Arznei aus dem Mittelalter: Sie tötet effektiv krankmachende Bakterien wie Staphylococcus aureus ab und wirkt gegen mikrobielle Biofilme, wie ein Experiment von Jessica Furner-Pardoe von der University of Warwick und ihren Kollegen enthüllt hat. Das Erstaunliche daran: Die tausend Jahre alte Augensalbe besteht nur aus Knoblauch, Zwiebel, Wein und Rindergalle. Während diese Zutaten einzeln kaum wirksam sind, sind sie zusammen unerwartet effektiv.
Und noch ein weiteres Hausmittel gilt als wirksam, um Infektionen zu verhindern: Dunkler Manuka-Honig ist nicht nur stark antibakteriell, sondern konnte in Untersuchungen von Bashir Lwaleed von der University of Southampton und seinem Team sogar Biofilme verhindern helfen. Schon eine stark verdünnte Honiglösung senkte die Haftung von Bakterienfilmen an Plastik und beeinträchtigte ihr Wachstum. ...

Biofilme wirksam bekämpfen
Die Überlebensstrategien von Bakterien in Biofilmen sind zwar hochwirksam. Dennoch konnten Wissenschaftler bereits erste präventive Maßnahmen sowie Bekämpfungsmittel bei einem Befall von Biofilmen entwickeln und forschen weiterhin an neuen Möglichkeiten. Ein Ansatzpunkt ist die Reinigung...
Mehr zum Manuka-Honig:
Manuka-Honig: Alle Infos zu Anwendung und Wirkung | Bee Careful
In der Naturheilkunde findet Manuka-Honig viel Anklang. Wir zeigen wie er wirkt und wie er angewendet wird. Ausserdem: So erkennt ihr echten Manuka.
Manuka-Honig - Eine Biologin erklärt den Wunderhonig
Wie wirkt Manuka-Honig? Was sind die Anwendungsgebiete? Studienlage? Worauf sollte man vor dem Kauf achten? Inklusive Video und informativer Info-Grafiken.
Auch andere Honigsorten scheinen dem Manuka-Honig ähnlich und ebenbürtig:
Blog - Griechischer Honig besser als Manuka Honig
 www.aroma-delikatessen.de
www.aroma-delikatessen.de
Angeblich gibt es auch dt. ökologische Honigsorten , die dem Manuka-Honig entsprechen.
Grüsse,
Oregano