Das Chronische Fatiguesyndrom (CFS), heute überwiegend als ME (Myalgic Encephalopathy) oder kombiniert als ME/CFS bezeichnet, ist definitionsgemäß eine chronische Multisystemerkrankung mit ausgeprägten somatischen und neurokognitiven Einschränkungen (Scheibenbogen, 2016). Vieles spricht inzwischen dafür, dass ME/CFS eine neuroinflammatorische Erkrankung ist (Morris, 2013). Die Zahl der Betroffenen wird in USA auf 800.000 – 2.500.000 und in Deutschland auf bis zu 300.000 geschätzt. Genaue Zahlen existieren jedoch nicht. Ca. 75% der Erkrankten sind Frauen mittleren Alters. Die Diagnose der Krankheit ist schwierig, subjektiv und nicht selten kontrovers. Derzeit wird die Krankheit nur nach subjektiven klinischen Symptomangaben diagnostiziert, häufig wesentlich am Symptom der chronischen Fatigue orientiert. Daher besteht die dringende Notwendigkeit einer objektiven, auf eindeutigen Markern basierten Diagnostik. Die fehlende Klarheit der Diagnosen ist verantwortlich, dass nicht selten kontroverse Ergebnisse in der CFS-Forschung zustande kommen.
Nach der CDC Definition von 1994 (Fukuda, 1994) ist das zentrale CFS-Kriterium ein über mindestens 6 Monate andauernder Zustand der zentralen Fatigue mit mehr als 50%iger Einschränkung der physischen und mentalen Leistungsfähigkeit, die durch Schlaf nicht verbessert und durch physische oder mentale Aktivität verstärkt wird. Der Verlust mentaler, psychischer und physischer Leistungsfähigkeit führt in der Regel zu anhaltender Arbeitsunfähigkeit und häufig zu dauerhafter Berufsunfähigkeit mit erheblichen sozioökonomischen Konsequenzen. Nach der CDC-Definition müssen außerdem mindestens vier der folgenden zusätzlichen Symptome erfüllt sein:
- Gestörter Schlaf mit Tagesmüdigkeit oder übermäßige Somnolenz
- protrahierte Erschöpfung nach physischer Belastung und verlangsamte Erholung > 24h
- Konzentrationsschwäche
- Muskelschmerzen
- multiple Gelenkbeschwerden
- Kopfschmerzen
- Halsschmerzen
- Lymphknotenschwellungen
Die CDC Definition wurde später um den Begriff der „Myalgic Encephalomyelitis“ erweitert (Carruthers, 2011), konsistent mit der neurologischen Klassifizierung in der „WHO International Classification of diseases“ mit dem ICD Schlüssel G93.3. ME wird als erworbene neurologische Erkrankung mit Dysregulation des Nerven-, Immun- und Hormonsystems und Einschränkung des Energiemetabolismus definiert. Danach wird das zentrale Kriterium der chronischen, mehr als 6 Monate andauernden Fatigue durch weitere essentielle klinische Kriterien erweitert, wobei vor allem die Belastungsinsuffizienz in den Vordergrund rückt:
A. Verstärkung der Beschwerden nach Belastung
PENE, Postexertional Neuroimmune Eexhaustion; PEM postexertionelle Malaise;
- schnelle körperliche und/oder kognitive Erschöpfung selbst nach minimaler Belastung
- infolgedessen generell reduzierte Aktivitäten
- unmittelbare oder u.U. bis z mehreren Tagen verzögerte Erschöpfung
- Verstärkung der Symptomatik nach Belastung
- verzögerte Erholung, in der Regel mindestens 24 h oder länger
B. Neurologische Störungen
- Neurokognitive Einschränkungen
Verwirrung, Konzentrationseinschränkungen, gestörtes Kurzzeitgedächtnis, gel. Dyslexie, Wortfindungs-, Koordinationsstörungen; - Schmerzen
Kopfschmerzen, chronisch, generalisiert; Spannungskopfschmerzen; Migräne
Myalgien, Palpitationen; Sehnenschmerzen; (u.U. Fibromyalgie-artig), Arthralgien;
Generalisierte Hyperalgesie; oft wandernde Schmerzen; - Schlafstörungen
Nicht erholsamer Schlaf, erhöhter Schlafbedarf, Tagesmüdigkeit; gestörter Schlafrhythmus;
gestörter Tag-, Nachtrhythmus; - Autonome Dysfunktion
Visusstörungen; gesteigerte Licht-, Lärm-, Geruchsempfindlichkeit; gestörte Tiefensensibilität; Muskelschwäche, Koordinationsstörungen, Standunsicherheit, Ataxie;
C. Immune, gastrointestinale und urogenitale Störungen; mindestens ein Symptom der Folgenden:
- Grippale Symptome , die bei Belastung zunehmen
- Gesteigerte Infektanfälligkeit; verlangsamte Erholung
- Gastrointestinal: Übelkeit, abdominelle schmerzen, Blähungen, Reizdarm
- Urogenital: Harndrang, Pollakisurie, Nykturie
- Unverträglichkeiten: Nahrungsmittel, Medikamente, Chemikalien, Geruchsstoffe
D. Energieproduktion; mindestens ein Symptom der Folgenden:
- Kardiovaskulär: Orthostatische Intoleranz, die auch verzögert eintreten kann; Hypotension, POTS, Rhythmusstörungen; Schwindel
- Respiratorisch: Atembeschwerden; Schwäche der Atemmuskulatur
- Körpertemperatur: gesenkte Körpertemperatur; Schwitzattacken, subfebrile Temperaturen, kalte Extremitäten
- Hitze-/Kälteintoleranz
E. Ausschlusskriterien sind organische Fatigue-Ursachen wie Hypothyreose, M. Addison, Hypothyreose, Tumorerkrankungen, chronische Infektionen, insbesondere infektiöse Mononukleose, Autoimmunerkrankungen, Drogenabusus, Adipositas, Essstörungen, Herzinsuffizienz, Schlafapnoe, Insomnie, Narkolepsie Schizophrenie, Majordepression. Dagegen sind leichtere Formen psychischer Störungen wie depressive Episoden oder Angststörungen häufige Begleitsymptome des CFS.
F. Komorbiditäten: Fibromyalgie; myofasziales Schmerzsyndrom; Temporomandibularsyndrom; Reizdarmsyndrom; interstitielle Zystitis; Ranynaudsyndrom; Mitralprolaps; Migräne, MCS (Mulitple Chemische Sensitivität; Hashimoto; Siccasyndrom; reaktive Depression.
Kürzlich wurde schließlich vom IOM (Institute of Medicine des NIH, USA, 2015) ein neuer Begriff für ME/CFS vorgeschlagen, der auf das einzige spezifische Symptom neben der chronischen Fatigue, die Verstärkung der Beschwerden nach Belastung (PEM, postexertionelle Malaise), fokussiert: SEID („Systemic Exertion Intolerance Disease“, Systemische Belastungsintoleranz-Erkrankung).
Seit einigen Jahren wird mit Hilfe aufwendiger Computer-basierte Datenanalysen verstärkt versucht, die „Core Symptome“, diejenigen Kriterien zu finden, die ME/CFS eindeutig von anderen Fatigueerkrankungen eindeutig unterscheiden können. Die beste Diskriminierung wird erreicht mit den folgenden 4 Kriterien (Jason, 2015): Fatigue, Belastungsinsuffizienz (PEM), neurokognitive Störungen und nicht-erholsamer Schlaf.
Pathophysiologie
Die Ursache des ME/CFS ist bis heute unbekannt. Unklar ist auch, ob es sich um ein oder um mehrere Krankheitsbilder mit vergleichbarer Symptomatik handelt. Ursprünglich wurde der Epstein-Barr-Virus (EBV) auf Grund auffälliger Antikörper-Titer als Ursache einer chronischen Erkrankung eingestuft („chronic infectious nucleosis-like syndrome“), die anschließend als CFS bezeichnet wurde (Jones, 1985). Auch der später neuentdeckte Herpesvirus 6 (HHV6) wurde immer wieder verantwortlich gemacht (Krüger, 1994). EBV ist auch heute noch in der Diskussion, vor allem wegen des komplexen Krankheitsbildes und der häufig lange (bis zu Jahren) anhaltenden Symptomatik nach einem initialen Pfeiffer’schen Drüsenfieber. EBV wird außerdem immer wieder als Ursache, zumindest aber als Trigger von Autoimmunerkrankungen (z.B. multiple Sklerose) gesehen und könnte den Boden bereiten für andere Infektionen und chronisch-inflammatorische Syndrome. Auch das Potential langfristiger Komplikationen von HHV6 und CMV ist bei weitem heute noch nicht ausgeschöpft. HHV6 wird z.B. im Zusammenhang mit Autoimmunsyndromen wie dem DRESS-Syndrom und ganz aktuell sogar mit Parkinson und Alzheimer diskutiert. Außer den Viren der Herpesgruppe, die alle nach Erstinfektion lebenslang als latente Infektionen persistieren und reaktivieren können, kamen wiederholt auch andere Viren wie Coxsackie und Parvovirus B19, Bakterien wie Coxiellen, Mykoplasmen, Chlamydien oder Borrelien als Ursache des CFS in Verdacht. Einzelfälle chronischer Fatigue mit Viruspersistenz wurden beschrieben, z.B. bei Enteroviren (Chia, 2010). Apathogene Mykoplasmen (Mp fermentans, Mp hominis und Mp penetrans) wurden beispielsweise bei mehr als 60% der CFS-Betroffenen gefunden und als Ursache diskutiert (Nasralla, 1999). Die Suche nach einer infektiösen Ursache des CFS hat jedoch bis heute zu keiner überzeugenden Antwort geführt (Cameron, 2010). In einer umfangreichen CDC „Four-City Surveillance“ wurde keine Assoziation zwischen CFS und einer Vielzahl von Infektionen einschließlich EBV, HHV6, humane Retroviren, Röteln, Parvovirus, Enteroviren (Coxsackie), Candida, Bornavirus oder Mykoplasmen gefunden.
Die Erkrankung beginnt meist nach einem Infekt – oder beginnt sie als Infekt? – gefolgt von unmittelbar anschließendem oder verzögertem Übergang in einen schweren Erschöpfungszustand (Fatigue), der länger als 6 Monate anhält. Auch andere starke physische oder mentale Belastungen wie chronischer psychosozialer Stress, körperliches Training im Hochleistungsbereich, Überanstrengungen, ev. auch übermäßige Umweltbelastungen werden als Auslöser des CFS diskutiert.
Die Fatigue wird von unterschiedlich ausgeprägten körperlichen und kognitiven Symptomen begleitet. Häufig stehen grippale Symptome wie Halsschmerzen, subfebrile Temperaturen, schmerzhafte Lymphknoten, Kopf- und Gliederschmerzen am Anfang. Dazu kommen Schlafstörungen mit erhöhtem Schlafbedarf, nicht-erholsamer Schlaf, Verlust des Tag-Nachtrhythmus; Erholungspausen bewirken keine Besserung. Nahezu immer entwickeln sich kognitive Probleme mit Einschränkung der Konzentration und Merkfähigkeit. Besonders belastend sind oft auch neurofunktionelle Störungen mit Schwindel, orthostatische Dysregulation, Visusstörungen, Miktionsbeschwerden, Reizdarm, Unverträglichkeiten, Hypersensitivitäten (Licht, Geräusche, Geruch). Selten, in ca. 10-30% der Fälle (Reeves, 2003) beginnt die Krankheit allerdings auch schleichend und verstärkt sich über Monate bis Jahre zum Vollbild des ME/CFS.
Die Fatigue kann so stark werden, dass die Betroffenen nicht nur unbestimmte Zeit arbeitsunfähig werden sondern auch einfache Alltagstätigkeiten (Haushalt) kaum noch bewältigen können und in seltenen Fällen sogar komplett bettlägerig werden. Neben der Fatigue ist die sog. postexertionelle Malaise (PEM) charakteristisch für die Erkrankung. Selbst geringste körperliche oder mentale Belastungen führen typischerweise zur Zunahme der Fatigue und ihrer Begleitsymptome. Die Malaise kann sofort nach Belastung oder verzögert beginnen und bis zu mehreren Tagen anhalten. Die PEM ist, im Unterschied zu allen anderen Symptomen das einzige spezifische Kriterium des ME/CFS im Vergleich zu anderen Fatigueerkrankungen. Daher auch der Vorschlag der neuen Bezeichnung SEID. Die Symptomatik ist in den meisten Fällen chronisch, nicht selten wechselnd stark. Das Spektrum der Komplikationen kann sich mit der Zeit verändern. Kurze Besserungsphasen können vorkommen, die Prognose ist jedoch insgesamt bis heute ungünstig. In Studien wurden bei 40% der Patienten Besserungen gefunden, 8 – 30% konnten sogar wieder arbeiten (Bested, 2015). Dabei ist allerdings zu bedenken, dass das ME/CFS-Krankheitsbild auch unterschiedliche Ursachen haben kann.
Die chronische Fatigue ist kein Alleinstellungsmerkmal des ME/CFS.
- Postinfektiöse chronische Fatigue, kann auch ohne die Entwicklung eines ME/CFS vorkommen. Die Fatigue endet mit der Erkrankung (Morris, 2016).
- Die Tumorassoziierte Fatigue (Minton, 2013) ist das besonders gefürchtete Hauptsymptom bei 50-96 % aller Tumorpatienten mit der Trias Müdigkeit, Leistungsschwäche und Depression. Sie ist neben Übelkeit die häufigste Nebenwirkung der Tumortherapie. Der Pathomechanismus der Tumorfatigue ist genauso wenig geklärt wie der des ME/CFS.
- Die Fatigue ist außerdem fast immer vorhanden bei Autoimmunerkrankungen wie z.B. MS (Ayache, 2017) und bei schweren Organerkrankungen. Auch bei ihnen wird die Ursache nur ansatzweise verstanden.
Alle genannten Fatiguesyndrome sind durch periphere und zentrale Immunaktivierung charakterisiert. Die zentrale Aktivierung proentzündlicher Zytokine ist daher zumindest ein wichtiger Teilaspekt der Fatigue, die als „central fatigue“ definiert wird (Chaudhuri, 2004). Vor allem Interleukin 1ß wird mit der Entwicklung der Fatigue assoziiert (Koo, 2008). IL-1ß ist außerdem ein negativer Regulator der Neurogenese im Hippocampus des Hypothalamus im ZNS. Die Neurogenese mit der Ausreifung von neuronalen Stammzellen im Hippocampus hat zentrale Bedeutung für die kognitive Funktion (O’Leime, 2017). Neben der Neuroinflammation ist übrigens auch Cortisol ein negativer Regulator der Neurogenese.
Messbare Anstiege von CRP und proentzündlichen Zytokinen wie Interleukin 1ß (IL-1ß), IL-6, IL-8, etc. wurden beim CFS beschrieben (Broderick, 2010; Landi, 2016). Die Ergebnisse der betreffenden Studien sind jedoch nicht einheitlich. Vor kurzem wurde der Abfall von IL-16, IL-17, VEGF, etc. unter 34 untersuchten Zytokinen und Chemokinen berichtet, der im Vergleich mit den Lebererkrankungen HCV, PBC, PSC und AIH hohe ME/CFS-Spezifität hatte (Landi, 2016). Deutlicher waren die Ergebnisse mehrerer Studien, bei denen Zytokine nach Belastung (Exercise) gemessen wurden. Erst kürzlich erschien eine besonders umfangreiche Studie mit der Bestimmung von 54 Zytokinen nach Exercise, bei denen eine Reihe von ME/CFS-spezifischen Anstiegen wie u.a. IL-1ß, CD40L und alpha-IFN gefunden wurden (Moneghetti, 2018).
Eigene Erfahrungen mit der Messung proentzündlicher Marker im Blut von CFS-Patienten sind unbefriedigend, nur sporadisch waren erhöhte Zytokine im Blut messbar (z.B. IL-6, MCP-1). Da vieles dafür spricht, dass ME/CFS in erster Linie eine neuroinflammatorische Erkrankung ist, ist die Inkonsistenz der peripheren Zytokinbestimmungen verständlich. Auch wenn in einzelnen Fällen erhöhte Zytokinaktivität im Blut gefunden wird, sind diese Ergebnisse diagnostisch nicht zielführend.
Stress-Immunachse
Proentzündliche Aktivität mit Neuroinflammation ist nicht nur Teil der o.g. primär immunologischen Fatiguesyndrome sondern kommt ebenso bei primär endokrinen Krankheiten mit Fatigue wie Hashimoto, Diabetes, Adipositas), bei Leberzirrhose, Herz- und Niereninsuffizienz und natürlich bei primär neuroinflammatorischen Syndromen wie Insomnie, Parkinson und Depressionen vor (Haapakoski, 2016, Miller, 2016).
Es ist sekundär, ob Inflammation peripher entsteht oder zentral durch Aktivierung des ZNS-Immunsystems (Mikroglia) beginnt. Periphere Immunaktivierung induziert immer auch zentrale Aktivierung, da die proinflammatorischen Aktivitäten aus der Peripherie über neuronale Signale (vagale Afferenzen), Zytokine oder auch Transpedese von Immunzellen selbst über die Blut-Hirnschranke in ZNS-Immunaktivität umgesetzt werden. Primär zentrale Inflammation bedingt dagegen nicht unbedingt messbare periphere Entzündungssignale.
Die zentrale inflammatorische Immunreaktion ist ein elementarer Mechanismus der Stressantwort (Bierhaus, 2003) – neben der Aktivierung der Stresshormonachse (HPT-HVL-NNR-Achse: Hypothalamus-Hypophysen-Nebennierenrinden-Achse), des zentralen (ZNS) und des peripheren autonomen Nervensystem (ANS). Übermäßiger Stress führt zur Symptomatik des sog. „Sickness Behaviour“ (Dantzer, 2008) das neben der zentralen Fatigue auch Müdigkeit, Schwäche, Schlafstörungen, subfebrile Temperaturen, grippale Symptomatik, Inappetenz und Schmerzen umfassen kann. Andauernder Stress („cytokine theory of disease“) begünstigt demnach psychische Komplikationen wie PTSD (Posttraumatisches Stress-Syndrom), Burnout und Depressionen (Dowlati, 2010). Anders gesagt, Personen die aufgrund angeborener oder erworbener Disposition betont entzündlich auf Stress reagieren, sind stärker gefährdet unter Stressbedingungen psychische Krankheiten zu entwickeln.
Die proentzündlichen Zytokine wie IL-1ß, TNF-alpha, IL-6 oder Interferon-gamma haben unmittelbaren Einfluss auf das Neurovegetativum. Sie können über Zytokinrezeptoren auf Gliazellen und auch auf Neuronen bzw. durch Stimulation der zentralen Zytokinsynthese (Mikroglia) im akuten Fall die Ausschüttung von CRH (ACTH) und von Neurotransmittern stimulieren und synergistisch die hormonelle und neuronale Stressantwort verstärken.
Dauerhaft bewirken inflammatorische Zytokine monoaminerge Dysfunktion, vor allem Interferon-gamma, das durch Aktivierung des Enzyms IDO (Indolamin-2,3-Dioxygenase) den Tryptophanmetabolismus in Richtung der Synthese von toxischen Kynureninen lenkt und die Serotoninsynthese reduziert (Abb. 1). Auch Melatonin wird durch IDO abgebaut, was zu Schlafstörungen beitragen kann.
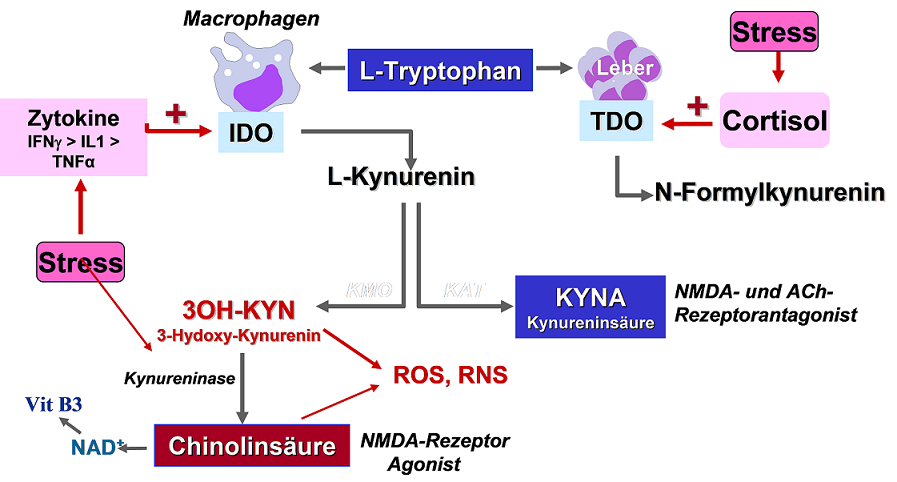
Abb. 1 Tryptophan – Inflammation: Tryptophan (Trp) wird vorwiegend zu Kynureninen metabolisiert, vor allem L-Kynurenin und Kynurensäure, die u.a. immunmodulatorisch und Glutamat-antagonistisch wirken. Bei Stress wird Trp unter dem Einfluss von Cortisol (Leber, Astrozyten, Niere) durch Induktion der TDO (Trp-Dioxygenase) verstärkt zu Kynureninen metabolisiert. Cortisol, Prolaktin und Tryptophan stimulieren die TDO-Aktivität, Antioxidantien, Antidepressiva (SSRI-Typ) und COX2-Inhibitoren wirken hemmend. Bei (Neuro)inflammation (Zytokine) wird Trp durch Induktion der IDO (Indolamin-Dioxygenase in Immunzellen/Makrophagen, Neuronen, Endothelien) verstärkt zu den prooxidativen Kynureninen 3OH-Kyn und Chinolinsäure (Cho) metabolisiert, die beide hochgradig prooxidativ, zytotoxisch wirken und ROS, RNS induzieren. Cho ist außerdem ein potenter Glutamatrezeptor-Agonist (NMDA) und wirkt auf diesem Wege exzitotoxisch zusätzlich neurotoxisch. In beiden Fällen (Stress, Zytokine) sinkt die Bildung von Serotonin aus Trp, es kommt zu neuroendokriner Dysfunktion. Die IDO-Aktivität wird durch Serotonin und Melatonin, COX2-Hemmer, Boswellia, Antioxidantien, Antidepressiva (SSRI), Lithium (Rubidium) oder Bupropion gehemmt.
Bei normalem, zeitlich begrenztem Verlauf der Entzündungsreaktion wird der vorübergehende Tryptophanabfall kompensiert. Bei längerer Entzündungsdauer kann der Abfall der Serotoninsynthese allerdings symptomatisch werden und zur Manifestation reaktiver Depressionen führen. Dies verdeutlicht nicht nur die Häufung depressiver Verstimmungen bei chronisch entzündlichen Prozessen deutlich sondern noch deutlicher die Entstehung schwerer Depressionen durch Zytokin-Therapie.
Darüber hinaus bewirkt gesteigerte Zytokinaktivität Hemmung der Aktivität zentraler Hydroxylasen, die wie die Trytophan- und Tyrosinhydroxylase bestimmend für die Synthese der Monoamin-Neurotransmitter (Serotonin, Katecholamine) sind (Miller, 2016). Die CFS-Symptomatik wie u.a. Fatigue, Müdigkeit, Schlafprobleme, kognitive Defizite und ev. auch reaktive Depressionen wird durch den neuroinflammatorisch bedingten Abfall der monoaminergen Aktivität begünstigt. Für die in diesen Fällen kausale Behandlung bietet sich die Serotoninvorstufe 5-HTP (5-Hydroxytryptophan) bzw. Antidepressiva vom SSRI-Typ (Selektive Serotonin-Reuptake-Inhibition).
Zu den wenigen labordiagnostisch auffälligen Besonderheiten des ME/CFS gehört der funktionelle Hypocortisolismus (Cleare, 2003), die reduzierte Cortisolsekretion und Abflachung des Cortisol-Biorhythmus, der bereits 1981 erstmals beschrieben wurde (Poteliakhoff). Der Nachweis des Hypocortisolismus gelingt am besten durch Bestimmung des Cortisol-Tagesprofils im Speichel oder von Gesamtcortisol im 24h Urin. Die Bestimmung von ACTH im Plasma oder ein ACTH-Test tragen ggf. zur Klärung bei, denn beim CFS ist außer Cortisol auch ACTH niedrig, während es bei adrenaler Insuffizienz im Feedback erhöht wäre. Der Hypocortisolismus wird oft als „Nebennierenschwäche“ („Adrenal Fatigue“) fehlinterpretiert. Der Hypocortisolismus des ME/CFS basiert auf hypothalamischer Dysfunktion, veränderter CRH-Sekretion und/oder verminderter Glukocorticoidrezeptor-Aktivität (Papadopoulos, 2009). Funktioneller Hypocortisolismus kennzeichnet auch Fibromyalgie, PTSD und die melacholische Depression. Der Hypocortisoismus bzw. die hypothalamische Dysfunktion gehen einher mit zentraler Fatigue, Schlafstörungen, Myalgien und Arthralgien (Vgontzas, 2006, Dantzer, 2008).
Cortisol hat fundamentale Bedeutung für die Funktion des Immunsystems (Oppong, 2015). Cortisolabfall geht parallel mit der Zunahme entzündlicher Aktivität, Anstieg von Zytokinen und mit zellulärer Immundysfunktion. Auf zellulärer Ebene steht der Antagonismus von Cortisol und NF-kB im Mittelpunkt. Der nukleäre Transferfaktor NF-kB, der jede Änderung der zellulären Homöostase auf veränderte Genexpression überträgt, hat zentrale Bedeutung für die Anpassung der Zelle/es Organismus an veränderte Umweltbedingungen, an Infektionen, chemische, oxidative Einflüsse, Schadstoffe, Stress. Der Hypocortisolismus des ME/CFS erhöht die Permessivität für entzündliche Prozesse, erleichtert aber die Reaktion der Zelle auf andere Störungen (Infekt, Stress ?).
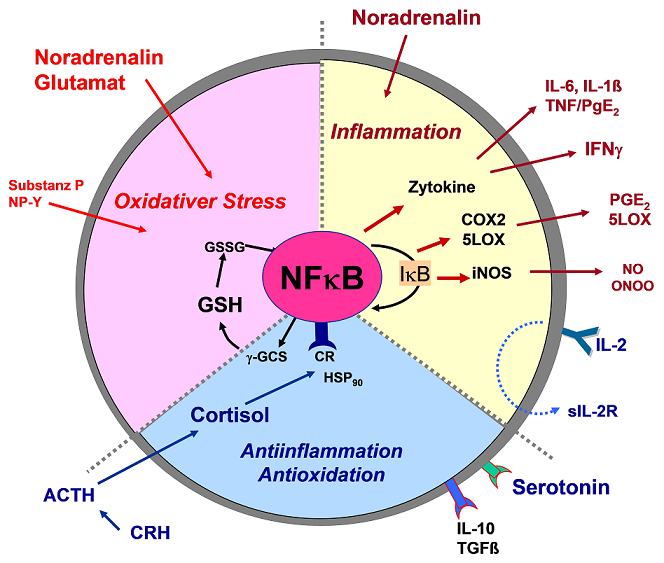
Abb 2: Schema der zellulären Neuro-Immunsynapse. Noradrenalin und Glutamin wirken prooxidativ, Noradrenalin akut proentzündlich. Neben Cortisol ist der Parasympathikus (Actylcholin) das wichtigste antientzündliche System. Auch Serotonin wirkt leicht entzündungshemmend, außerdem IL-2/T-Zell-stimulierend. Die zentrale zelluläre Schaltungsebene für diese Aktionen sind die sog. REDOX-sensitiven nukleären Transferfaktoren wie NF-kB. Über NF-kB Aktivierung werden die inflammatorischen Zytokine induziert, ebenso proentzündliche Enzyme (COX2, 5-LOX) bzw. pro- (iNOS) und antioxidative (Glutathionsynthase) Enzyme. Die neuroendokrinen Faktoren modulieren hemmend (Cortisol, Serotonin, ACh) oder aktivierend (Noradrenalin, Glutamat, Substanz P, NPY) das NF-kB-Aktivitätsniveau, entweder durch direkte Interaktion mit NF-kB oder über das NFkB-Inhibitorsystem I-kB.
Die Ursache der zentralen Immunaktivierung bei ME/CFS ist bis heute ungeklärt. Der Hypocortisolismus ist sicher ein Teilaspekt. Die Tatsache, dass trotz immer intensiverer Suche bis heute weltweit keine Ursache für ME/CFS zweifelsfrei festgestellt wurde, spricht allerdings für einen sehr ungewöhnlichen Verlauf bei individueller Disposition; oder es handelt sich um einen bisher völlig unbekannten Pathomechanismus. Derzeit bieten sich mehr oder weniger überzeugend folgende Erklärungsmodelle an:
- Protrahierte oder chronische Infektionen sind weiterhin vorrangig in der Diskussion, an erster Stelle die EBV-Infektion. Infolge individueller Besonderheiten, z.B. angeborene oder erworbene Defekte der NK- bzw. T-Zellzytotoxizität, Mutationen mit Störung der CD4T-B-Zellkommunikation, angeborene Mängel von Faktoren, die die Immuntoleranz einschränken, auch durch Interferenz mit anderen, ebenfalls präsenten Herpesviren (HHV6 > HCMV) kann die Infektion in unterschiedlicher Latenz chronisch aktiv sein oder häufig reaktivieren. Die Fatigue kann in der Folge persistieren und weitere Komlikationen entstehen (Cruz-Munoz, 2018). In der ersten Beschreibung von Patienten mit chronischer Fatigue schilderte DuBois 1984 Patienten mit einem Mononukleosis-Syndrom und serologischer Evidenz einer aktiven von EBV-Infektion. Andere Erreger wie Parvovirus B19, Enteroviren und intrazelluläre Bakterien (Chlamydien, Borrelien) wurden zwar immer wieder benannt, überzeugende Belege fehlen jedoch, auch wenn die betreffenden Infektionen chronisch verlaufen können und die Fatigue ein zentrales Symptom ist. Diesen Infektionen fehlen weitere, ME/CFS-wesentliche Charakteristika. EBV wird nicht nur wegen der Häufung ungewöhnlich protrahierter Verläufe nach Erstinfektion (oder nach Reaktivierung ?) immer an erster Stelle genannt, sondern auch wegen seiner besonderen immunologischen Wirkungen. EBV verfügt über besondere Immunmechanismen, die Toleranz-induzierend wirken und zelluläre Immundysfunktion begünstigen.
. - In den letzten Jahren kam die Überlegung in Diskussion, dass nicht konventionelle Viren mit atypischem Infektionsverlauf sondern normalerweise apathogene humane endogene Retroviren (HERV’s) durch Viren wie EBV aktiviert werden und zum eigentlichen Motor der chronischen Krankheit werden (Mameli, 2012). Dafür sprechen einzelne Behandlungserfolge mit Retrovirostatika (ARV’s), die sich bereits in der AIDS-Therapie bewährt haben (revTranscriptasehemmer, Proteaseinhibitoren, Integrasehemmer). Meine persönlichen Erfahrungen mit der Anwendung von ARV’s bei ME/CFS beschränken sich auf Einzelfälle, von denen einer sehr erfolgreich zu sein scheint, während andere keine Besserung brachten.
. - Auch für die Autoimmungenese von ME/CFS finden sich immer mehr Anhaltspunkte (Morris, 2014; Blomberg, 2018; Sotzny, 2018). In erster Linie Virusinfektionen wie EBV, gelten heute als maßgebliche Ursachen oder zumindest als Trigger für Autoimmunerkrankungen. EBV und HHV6 werden z.B. mit multipler Sklerose und Kollagenosen in Verbindung gebracht. Verschiedene EBV-Antigene (EBNA2) weisen Homologie zu neuronalen Antigenen auf (Harley, 2018). Immundysfunktion mit gestörter Toleranz gegenüber kreuzreaktiven mikrobiellen Antigenen (Molecular Mimicry) begünstigt die Entwicklung von Autoimmunität. Bei ME/CFS-Patienten besteht häufig ein Reizdarm-Syndrom, verbunden mit Störung der Darm-Barrierefunktion und intestinalen Unverträglichkeiten. Die daraus folgenden Änderungen der systemischen Immuntoleranz begünstigen kreuzreaktive Autoimmunität.
Der Verdacht auf Autoimmungenese des ME/CFS bekam nach erfolgreicher Behandlung von Lymphom-Patientin mit dem chimären CD20-Antikörper Rituximab, bei denen auch die CFS-Symptomatik verschwand, besondere Aktualität (Fluge, 2011). Die anfangs vielversprechenden Behandlungsergebnisse bei weiteren ME/CFS-Patienten (Fluge, 2015) erreichten aber letztlich keine Signifikanz. Ein nicht-signifikanter Anteil der Patienten in den Rituximab-Studien erfuhr allerdings deutliche Verbesserungen, zum Teil auch bleibend. Rituximab wird vielfach bei Autoimmunerkrankungen eingesetzt. Es wirkt durch Reduktion der Antikörper-bildenden B-Lymphozyten. Das Risiko schwerer Nebenwirkungen bis zu einzelnen tödlichen Fällen ist allerdings nicht unerheblich.
Das vermehrte Vorkommen von Autoantikörpern gegen Neurotransmitter-Rezeptoren wie 5HTR1A (Serotonin), DRD2 (Dopamin), M3/4 AChR (Acetylcholin) und ß1/ß2R (Nor/Adrenalin) wurde mehrfach beschrieben. Unklar, inwieweit die beschriebenen Rezeptor-AAK auch pathogenes Potential besitzen, denn der Nachweis als solcher bedingt nicht zwangsläufig auch Pathogenität. Pathogenetisch relevante Katecholaminrezeptor- und Acetylcholinrezeptor-AAK werden bevorzugt bei Cardiomyopathien und beim schweren Orthostase-Syndrom, dem POTS (posturales orthostatisches Tachykardiesyndrom), gefunden. Orthostase-Beschwerden bis zum Vollbild des POTS kommen bei ME/CFS häufig vor.
Genetische Faktoren
Das Fehlen eines eindeutigen, pathognomonischen Markers odereindeutigen klinischen Tests für ME/CFS hat wiederholt die Suche nach individuellen genetischen Dispositionsfaktoren stimuliert, die die „Entgleisung“ bzw. Chronifizierung der Fatigue individuell erklären könnten. CFS ist nicht erblich, allerdings scheinen diskrete erbliche Risikokonstellationen zu exisiteren. Bei monozygoten Zwillingen fand sich allerdings Konkordanz marginal häufiger als bei dizygoten Zwillingen. Auch bei Verwandten ersten Grades scheint das ME/CFS-Risiko erhöht zu sein. Einzelne Immunglobulin-Defekte (IgG-Subklassen) kommen anscheinend häufiger als normal vor, spielen jedoch insgesamt keine nennenswerte Rolle. Genetische Polymorphismen von gamma-Interferon und TNFalpha wurden häufiger beobachtet. Auch Bestimmte HLA-Faktoren (HLA DR4, HLA DQA1*01) wurden als genetische Risikomarker für CFS vorgeschlagen. Wesentlich häufiger wird verminderte NK-Zellaktivität bei ME/CFS gefunden (Nguyen, 2018), dürfte jedoch eher Folge /veränderte Genexpression) als Ursache (genetische Anomalien) sein.
2006 wurden die Ergebnisse eines CDC Schwerpunktprogramms zur Genetik des ME/CFS publiziert und füllten ein ganzes Heft von Pharmacogenomics (7/3). Ein aufwendiges Projekt mit umfangreichem Screening der Genexpression von insgesamt 20.000 Genen wurde bei 172 CFS-Patienten durchgeführt, darunter 500 Gene neuroregulatorischer Komponenten. CFS-typische Unterschiede wurden bei 28 Genen gefunden, die alle in Immunfunktion, Zellkommunikation und Stressresponse involviert sind. In einem zweiten Projekt wurden 50 Gene eingehender auf charakteristische Genvarianten geprüft und auf drei neuroregulatorischen Genen vier bzw. fünf Polymorphismen identifiziert, denen ca. 75% prädiktiver Wert für die Diagnose des CFS zuerkannt wurde (Goertzel; 2006; Smith, 2006). Mit leistungsfähigeren Techniken (GWAS, „genome-wide association study“) wurden kürzlich 906.600 SNP’s („single nucleotide polymorphisms“) bei 80 ME/CFS Patienten untersucht. Dabei fanden sich 442 SNP’s, die statistisch signifikant mit dem Kollektiv korrelierten, darunter 12 SNP’s in Coding-Regionen der betreffenden Gene, mehr als 95% in non-coding- Abschnitten (Schlauch, 2016).
Belastungsintoleranz (PEM)
Die Entstehung der Fatigue kann mit heutigem Wissen weitgehend nachvollzogen werden. Proentzündliche Zytokine wie IL-1ß, der Hypocortisolismus und Neurotransmittermangel (biogene Amine Serotonin- und Katecholamine, insbesondere Dopamin) sind offensichtlich relevante Faktoren. Die Genese der Belastungsinsuffizienz (PEM: postexertionelle Malaise) beim ME/CFS ist demgegenüber unklar. Neuerdings werden allerdings vermehrt Anstrengungen unternommen, den Pathomechanismus der PEM zu verstehen. Belastungstests hatten gezeigt, dass der aerobe Metabolismus bei ME/CFS gestört ist (Keller, 2014). Die verminderte aerobe Energiebereitstellung bewirkt schnellere muskuläre Ermüdung. Eine Folge von gestörter aerober Energiegewinnung ist der höhere Anstieg von Lactat (Blut, Liquor) nach Belastungen und gesteigerter Anfall von oxidativen Metaboliten, da intermediäre Sauerstoffradikale vermehrt aus dem oxidativen Phosphorylierungsprozess der Atmungskette herausfallen. Bei ME/CFS wurde wiederholt gesteigerter Lactatanfall nach Belastungen und Anstieg von oxidativen Spezies (ROS)gefunden (Blomberg, 2018).
Aufwendige Genexpressionsstudien in Ruhe und nach Belastung haben signifikante metabolische Besonderheiten bei ME/CFS gezeigt, die auf mitochondriale Dysfunktion hinweisen. Die Funktion der Pyruvatdehydrogenase (PDH), eines mitochondrialen Schlüsselenzyms, ist bei M/CFS gestört (Fluge, 2016). Konsequenterweise konnte kürzlich durch DCA (Dichloracetat) die Fatigue und Energiereserve bei ME/CFS-Patienten signifikant verbessert und die mitochondriale ATP-Ausbeute erhöht werden (Comhaire, 2018). DCA hemmt das Enzym PDH-Kinase, wodurch die PDH-Aktivität gesteigert und die mitochondriale Energiegewinnung verbessert wird.
In-vitro Untersuchungen an isolierten Muskelzellen haben gezeigt, dass die Aktivität des Enzyms AMPK (AMP-activated protein kinase) und die Glucoseaufnahme bei ME/CFS gestört sind. AMPK ist das Schlüsselenzym für die Anpassung der muskulären Energiegewinnung an Belastungen. Es katalysiert die Umschaltung von ATP-Verbrauch zur ATP-Gewinnung und in der Folge die erhöhte Aufnahme von Glucose. Durch Zugabe von Metformin, das die AMPK-Aktivität steigert, konnte daher die Energiegewinnung bei ME/CFS verbessert werden (Brown, 2018).
Schon früher wurde beobachtet, dass Homocystein, ein Marker des One-Carbon-Metabolismus, bei ME/CFS häufig erhöht ist, gelegentlich auch nur im Liquor nachweisbar. Die Behandlung mit den als Kofaktoren des Homocystein-Metabolismus eminent wichtigen Vitaminen B6, B12 und B9 kann oft „Brain Fog“ und kognitive Defizite bei ME/CFS verbessern (Regland, 2015).
Viele Untersuchungen zeigen, dass die Stoffwechselstörungen bei ME/CFS fundamental sind und weit über die PDH-Hemmung hinausgehen. Siefokussieren sich u.a. in der Störung des „One-Carbon“-Metabolismus. Naviaux (2016) untersuchte 612 Metaboliten von 63 Stoffwechselwegen im Plasma von Patienten mit ME/CFS. 80% der Metaboliten in 9 auffälligen Stoffwechselwegen waren vermindert, entsprechend einem hypometabolischen Status, der sowohl für männliche als auch weibliche ME/CFS Patienten > 90% Signifikanz zeigte. Nur 25% der metabolischen Besonderheiten reichen bereits aus für die CFS Diagnose, 75% waren individualtypisch. Neben dem mitochondrialen war u.a. auch der Metabolismus der Sphingolipide, Purine, Cholesterin, Riboflavin, BCAA, Mikrobiom und Peroxisomen reduziert. Alle metabolischen Besonderheiten, die gefunden wurden, sind abhängig von der zellulären REDOX-Kapazität und der Verfügbarkeit von NADPH. Die gleiche metabolische Charakteristik findet sich beim CDR („Cell Danger Response“) von Zellen unter Umweltstress, allerdings im akuten Fall mit Steigerung der metabolischen Aktivität. Der für ME/CFS typische Aktivitätsabfall könnte ein ökonomischer Anpassungsmodus an andauernde Belastungen sein.
Grundsätzlich ist der CDR die physiologische Reaktion der Zelle auf äußere Belastungen, die die zelluläre Homöostase fordern (Naviaux, 2014). Er umfasst metabolische, oxidative ebenso wie antioxidative, inflammatorische ebenso wie antiinflammatorische und hormonelle Prozesse bis zur Mitogenese (Neubildung von Mitochondrien).
Die entstehende Diskrepanz zwischen unmittelbar verfügbaren Resourcen und Anforderungen an die Zelle induziert eine Vielzahl von metabolischen und immunologischen Reaktionen. Die systemische Koordination des CDR erfolgt über den Hirnstamm. Wenn der CDR übermäßig lang andauert, wird die Funktion des gesamten Organismus zunehmend gestört und es kommt zu Krankheiten.
Fast alle Untersuchungen, in denen selektive Besonderheiten für ME/CFS erarbeitet wurden, basieren auf Vergleichen zwischen Betroffenen und gesunden Kontrollen. Inwieweit die Besonderheiten im Einzelnen absolut spezifisch für ME/CFS sind und bei keiner anderen Krankheit auftreten, ist in vielen Punkten offen und gehört zu den wichtigsten zukünftigen Aufgaben. Inzwischen scheint es möglich, die vielen Beobachtungen, die in den letzten Jahren zusammengekommen sind, zu einem höchst sensitiven und spezifischen Biomarker-Panel zusammenzufassen. Schließlich bleibt dann noch die Frage nach der Ursache der Krankheit.
Viele Versuche sind unternommen worden, unverwechselbare Kriterien für ME/CFS zu finden. Zahlreiche funktionelle radiologische Untersuchungen zeigten Unterschiede zwischen ME/CFS-Patienten und Gesunden, die allerdings kontrovers diskutiert wurden (Zeineh, 2015). Barnden (2011) fand Belege für Hirnstamm-Veränderungen, die verschiedentlich kontrovers gesehen und auch kürzlich nur teilweise bestätigt wurden (Finkelmeyer, 2018).
Zusammenfassung
Die Pathogenese des CFS ist auch nach aktuellem Wissensstand offen. Vieles erscheint allerdings heute wesentlich klarer, da die wissenschaftliche Auseinandersetzung mit der Krankheit – außer in Deutschland – erfreulicherweise stark zugenommen hat und seit kurzem vor allem in Amerika mit erhöhtem Einsatz maßgeblicher Forschungseinrichtungen (Stanford, Harvard, NIH) erfolgt. Eine Arbeitshypothese hat die wesentlichen Erkenntnisse zur CFS-Pathogenese, die bis heute gewonnen wurden, zusammenzuführen. Dies sind vor allem die Anzeichen gesteigerter Immunaktivität, chronische bzw. reaktivierte Virusinfektionen (EBV, HHV6), Neuroinflammation, zelluläre Immundysfunktion (T- und NK-Zellen), Autoimmunität, die neuroendokrine Dysregulation (HPA-Achse, Hypocortisolismus, Neurotransmitter) und die autonome Dysfunktion. Dazu kommen ev. genetische Dispositionsfaktoren.
Die Core Symptome sind:
- Chronische Fatigue
- Belastungsinsuffizienz (PEM)
- Neurokognitive Störungen
- Nicht-erholsamer Schlaf
Das aktuell attraktivste Erklärungsmodell für ME/CFS geht von einer viralen Infektion als Auslöser der Erkrankung aus. Genetische und erworbene Disposition und hochgradige physische oder mentale Stressbelastung zum Zeitpunkt der Infektion begünstigen einen protrahierten Verlauf mit andauernder Fatigue. Nach wie vor ist EBV der wahrscheinlichste Kandidat. Auch wenn u.a. Borrelien, HHV6, Parvovirus, Q-Fieber, Chlamydien protrahierte Infektionen mit ausgeprägter Fatigue verursachen können, ist ihre Wahrscheinlichkeit als Auslöser verschwindend gering. Sie sind im Unterschied zu ME/CFS nicht ubiquitär vorkommend und erfüllen kaum die zentralen Kriterien des ME/CFS.
Die heutige Lebensweise mit verstärkter Hygiene, weniger Infektionen, erhöhter chemischer Belastung, vermehrtem Stress, komplexen Nahrungsgewohnheiten und Änderung der Mikrobiomfunktion hat die Polarität des Immunsystems verändert und begünstigt die Entstehung von Allergien, Autoimmunerkrankungen und auch von Psychopathien. Die fortdauernde Immunaktivierung mit Merkmalen der Neuroinflammation und die virale Antigenverwandschaft begünstigen die Entstehung neuronaler Autoimmunität. In Einzelfällen wird ev. auch die Pathogenität von HERV’s gebahnt. induziert. In der Folge zunehmende neurokognitive Beschwerden bis zum Vollbild des ME/CFS.
Diagnostik
Die Labordiagnostik hat bei dem Fehlen spezifischer Marker vorrangig zum Ziel, Erkrankungen mit vergleichbarer Fatiguesymptomatik auszuschließen, d.h. chronische/reaktivierte Infekte, Autoimmunkrankheiten Neuropathienund Endokrinopathien; außerdem Feststellung etwaiger symptomatischer Begleiterkrankungen wie Immundefekte, Allergien, Unverträglichkeiten, Magen-Darmerkrankungen, Mikronährstoffmängel. Parallel müssen psychomentale Störungen ggf. ausgeschlossen, die autonome Funktion (HRV/Herzraten-Variabilität) und möglichst auch die Belastbarkeit untersucht werden.
- Neuroendokrinium: Cortisoltagesprofil, Neurotransmitter; Schilddrüsenhormone; LH, FSH, Prolaktin; Androgen/Östrogenstatus, PREGS, DHEAS. ggf. ACTH, ACTH-Test; NSE, S-100, CGA
- Immunität: IgG,A,M, IgG-Subklassen; MBL (Mannose-bindendes Lectin), CRPs, IL-1ß, IL-6, TNFalpha, sIL2R, MCP-1; NK-Zellfunktion
- Infektionen: EBV, CMV, HHV6, Borrelien-Serologie, ggf., Virusnachweis; antivirale (autoimmune) Genexpression (MxA, IFNß, RIG-I, EBI2); ggf. Hepatitis, Chlamydien, Q-Fieber, Rickettsien; revTranscriptase
- Autoimmunität: ANA, ENA, Gangliosid-Ak, Neurorezeptor-AAK
- Nährstoffstatus: Ferritin, Homocystein, Holotranscobalamin, Vit B2, B6, B9;, Vitamin D, PTH/Parathormon
- Unverträglichkeiten: Gluten, Gliadin, DAO, Histamin
- REDOX-Status Nitrotyosin, MDA, Coenzym Q10
- Autonome Funktion: HRV/Herzraten-Variabilität
Behandlungsoptionen
Antiviral, anti-retroviral;
Hormonell je nach Laborbefund; ev. Hydrocortison (selten wirksam); Pregnenolon;
Q10, B-Vitamine, Vitamin D, DCA, Metformin;
S-Adenosylmethionin, Acyl-Carnitin;
NAD-Ribosid; NADH;
Methylphenidat (BTM); Dexamphetamine (BTM);
Modafinil ®;
Melatonin; Octacosanol;
5HTP, Tyrosin, Mucuna; Glycyrrhizin;
Rhodiola, Ginseng;
Literatur
Ayache SS, Chalah MA. Fatigue in multiple sclerosis — Insights into evaluation and management. Neurophysiol Clin 2017; 47: 139-171
Barnden LR, Crouch B, Kwiatek R, et al. A brain MRI study of chronic fatigue syndrome: evidence of brainstem dysfunction and altered homeostasis. NMR Biomed 2011; 24: 1302-12
Bested AC, Marshall LM. Review of Myalgic Encephalomyelitis/Chronic Fatigue Syndrome: an evidence-based Approach to diagnosis and management by clinicians. Rev Environ Health. 2015;30: 223-49
Bierhaus A, Wolf J, Andrassy M, et al: A mechanism converting psychosocial stress into mononuclear cell activation. Proc Natl Acad Sci USA 2003; 100: 1920-25
Blomberg J, Gottfries CG, Elfaitouri A, et al. Infection elicited autoimmunity and myalgic encephalomyelitis/chronic fatigue syndrome: an explanatory model. Front Immunology 2018; 9: 229
Brandon LR, Kwiatek R, Crouch B, et al. Autonomic correlations with MRI are abnormal in the brainstem vasomotor centre in Chronic Fatigue Syndrome. NeuroImage Clin 2016; 11: 530-537
Brown AE, Dibnah B, Fisher E, et al. Pharmacological activation of AMPK and glucose uptake in cultured human skeletal muscle cells from patients with ME/CFS. Biosci Rep 2018; 38: BSR20180242
Cameron B, Flamand L, Juwana H, et al. Serological and Virological Investigation of the Role of the Herpesviruses EBV, CMV and HHV-6 in Post-Infective Fatigue Syndrome. J Med Virol 20ß10; 82: 1684-88
Carruthers BM, van den Sande MI, DeMerleir KL, et .al. Myalgic encephalomyelitis: intenational consensus criteria. J Intern Med 2011; 270: 327-338
Chaudhuri A, Behan PO. Fatigue in neurological disorders. Lancet 2004; 363: 978-988
Chia J, Chia A, Voeller M, Lee T, Chang R. Acute enterovirus infection followed by myalgic encephalomyelitis/chronic fatigue syndrome (ME/CFS) and viral persistence. J Clin Pathol 2010; 63: 165-168
Cleare AJ: The neuroendocrinology of chronic fatigue syndrome. Endocrine Rev 24: 236-52, 2003
Comhaire F. Treating patients suffering from myalgic encephalopathy/chronic fatigue syndrome (ME/CFS) with sodium dichloroacetate: An open-label, proof-of-principle pilot trial. Med Hypotheses 2018; 114: 45-48
Committee on the diagnostic criteria for ME/CFS: Beyond myalgic encephalomyelitis/chronic fatigue syndrome. Redefining an illness. Institute of Medicine, ISBN978-0-309-31689-7, 2015
Cook DB, Light AR, Light KC, et al. Neural consequences of post-exertion malaise in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome. Brain, Behavior, and Immunity 2017; 62: 87-99
Cruz-Munoz ME, Fuentes-Panana EM. Beta and Gamma Human Herpesviruses: Agonistic and Antagonistic Interactions with the Host Immune System. Front Microbiol 2018; 8: 2521
Dantzer R, O’Connor JC, Freund GG, et al.. From inflammation to sickness and depression: when the immune system subjugates the brain. Nat Rev Neurosci 2008; 9: 46-56
Dowlati Y, Herrmann N, Swardfager W, et al. A Meta-Analysis of Cytokines in Major Depression. Biol Psychiatry 2010;67:446–457
Finkelmeyer A, MacLachlan L, Watson S, et al. Grey and white matter differences in Chronic Fatigue Syndrome – A voxel-based morphometry study. Neuroimage Clin 2018; 17: 24-30
Fluge O, Bruland O, Risa K, et al. Benefit from B-lymphocyte depletion using the anti-CD20 antibody rituximab in chronic fatigue syndrome. A double-blind and placebo-controlled study. PLoS One. 2011; 6(10):e26358
Fluge O, Risa K, Alme K, et al B-Lymphocyte Depletion in Myalgic Encephalopathy/ Chronic Fatigue Syndrome. An Open-Label Phase II Study with Rituximab Maintenance Treatment PLoS One 2011;6(10):e26358
Fluge O, Bruland O, Risa K, et al. Metabolic profiling indicates impaired pyruvate dehydrogenase function in myalgic encephalopathy/chronic fatigue syndrome. JCI Insight. 2016; 1(21):e89376
Fukuda K, Straus SE, Hickie I et al. Chronic Fatigue Syndrome: a comprehensive approach to its definition and study. Ann Intern Medc1994;121:953–9.
Goertzel BN, Pannachin C, de Souza Coelhi L, et al: Combination of single nucleotide polymorphisms in neuroendocrine effector receptor genes predict chronic fatigue syndrome. Pharmacogenomics 2006; 7: 475-83
Haapakoski R, Ebmeier KP, Alenius H, Kivimäki M. Innate and adaptive immunity in the development of depression: An update on current knowledge and technological advances. Progr Neuropsychopharmacol Biol Psychiatry 2016; 66: 63-72
Harley JB, Chen X, Pujato M, et al. Transcription factors operate across disease loci, with EBNA2 implicated in autoimmunity. Nature Genet 2018; 50: 699-707
Jason LA, Kot B, Sunnquist M, et al. Comparing and contrasting consensus versus empirical domains. Fatigue: Biomedicine, Health & Behavior 2015; 3: 63–74.
Jones JF, Ray CG, Minnich LL, et al. Evidence for active Epstein-Barr virus infection in patients with persistent, unexplained illnesses; elevated anti-early antigen antibodies. Ann Intern Med 1985; 102: 107
Keller BA, Pryor JL, Giloteaux L. Inability of myalgic encephalomyelitis/ chronic fatigue syndrome patients to reproduce VO(2)peak indicates functional impairment. J Transl Med 2014; 12:104
Koo JW, Duman RS. IL-1_ is an essential mediator of the antineurogenic and anhedonic effects of stress. Proc Natl Acad Sci USA 2008; 105: 751-756
Krüger GR, Klueppelberg U, Hoffmann A, et al. Clinical correlates of infection with human herpesvirus 6. In Vivo 1994; 8: 457-85
Landi A, Broadhurst D, Vernon SD, et al. Reductions in circulating levels of IL-16, IL-7 and VEGF-A in myalgic encephalomyelitis/chronic fatigue syndrome. Cytokine 2016; 78: 27-36
Leonhard. The concept of depression as a dysfunction of the immune system. Curr Immunol Rev 2010; 6: 205-212
Lynn M, Maclachlan L, Finkelmeyer A, et al. Reduction of Glucocorticoid Receptor Function in Chronic Fatigue Syndrome. Mediators Inflamm 2018; Jun 10; 3972104
Mameli G, Poddighe L, Mei A, et al. Expression and Activation by Epstein Barr Virus of Human Endogenous Retroviruses-W in Blood Cells and Astrocytes: Inference for Multiple Sclerosis. PLOS one 2012; 7(9): e44991
Miller AH, Raison CL. The role of inflammation in depression: from evolutionary imperative to modern treatment target. Nature Rev Immunol 2016; 16: 22-34
Minton O, Berger A, Barsevick A, et al. Cancer-related fatigue and its impact on functioning. Cancer 2013; 11: 2124–2130
Morris G, Maes M. A neuro-immune model of Myalgic Encephalomyelitis/Chronic fatigue syndrome, Metab. Brain Dis 2013; 28: 523–540
Moneghetti KJ, Skhiri M, Contrepois K, et al. Value of Circulating Cytokine Profiling During Submaximal Exercise Testing in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome.Sci Rep 2018; 8: 2779
Morris G, Berk M, Galecki P, Maes M. The Emerging Role of Autoimmunity in Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/cfs). Mol Neurobiol 2014; 49: 741-756
Morris G, Berk M, Walder K, Maes M. The Putative Role of Viruses, Bacteria, and Chronic Fungal Biotoxin Exposure in the Genesis of Intractable Fatigue Accompanied by Cognitive and Physical Disability. Mol Neurobiol 2016; 53: 2550-2571
Nasralla M, Haier J, Nicolson GL: Multiple mycoplasmal infections detected in blood of patients with chronic fatigue syndrome. Eur J Clin Microbiol Infect Dis 1999; 18: 859-865
Naviaux RK. Metabolic features of the cell danger response. Mitochondrion 2014; 16: 7-17
Naviaux RK, Naviaux J, Li k, et al. Metabolic features of chronic fatigue syndrome. Proc Natl Acad Sci USA 2016; 114: E5472-E5480
Nguyen T, Staines D, Johnston S, Marshall-Gradisnik S. Reduced glycolytic reserve in isolated natural killer cells from Myalgic encephalomyelitis/chronic fatigue syndrome patients: A preliminary investigation. Asian Pac J Allergy Immunol. 2018;. doi: 10.12932
O’Leime CS, Cryan JF, Nolan YM. Nuclear deterrents: Intrinsic regulators of IL-1β-induced effects on hippocampal neurogenesis. Brain Behav Immun 2017; 66: 394-412
Oppong E, Cato AC. Effects of Glucocorticoids in the Immune System. Adv Exp Med Biol. 2015; 872: 217-33
Papadopoulos A, Ebrecht M, Roberts ADL, et al. Glucocorticoid receptor mediated negative feedback in chronic fatigue syndrome using the low dose (0.5 mg) dexamethasone suppression test. J Affect Disord 2009; 112: 289-294
Poteliakhoff A: Adrenocortical activity and some clinical findings in chronic fatigue. J Psychosom Res 25: 91-95, 1981
Regland B, Forsmark S, Halaouate L, Matousek M, Peilot B, Zachrisson O, et al. Response to vitamin B12 and folic acid in myalgic encephalomyelitis and fibromyalgia. PLoS One 2015; 10: e0124648.
Scheibenbogen C, Grabowski P. Harrisons Innere Medizin, 19. Auflage, deutsche Ausgabe, Kapitel 464e CFS, 2016.
Schlauch KA, Khaiboullina SF, DeMeirleir KL, et .al. Genome-wide association analysis identifies genetic variations in subjects with myalgic encephalomyelitis / chronic fatigue syndrome. Transl Psychiatry 2016; &: e730
Shan ZY, Finegan K, Bhuta S, et al. Brain function characteristics of chronic fatigue syndrome: A task fMRI study. Neuroimage Clin 2018; 19: 279-286
Smith AK, White PD, Aslakson E, et al. Polymorphisms in genes regulating HPA axis associated with empirically delineated classes of unexplained chronic fatigue. Pharmacogenomics 2006; 7:387-94
Sotzny F, Blanco J, Castro-Marrero J, et al. Myalgic Encephalomyelitis/Chronic Fatigue Syndrome – Evidence for an autoimmune disease. Autoimm Rev 2018; 17: 601-609
Zeineh MZ, Kang J, Atlas SW, et al. Right Arcuate Fasciculus Abnormality in Chronic Fatigue Syndrome. Radiology 2015; 274: 517-526




Ein Kommentar in “ME/CFS – die unbekannte Krankheit”