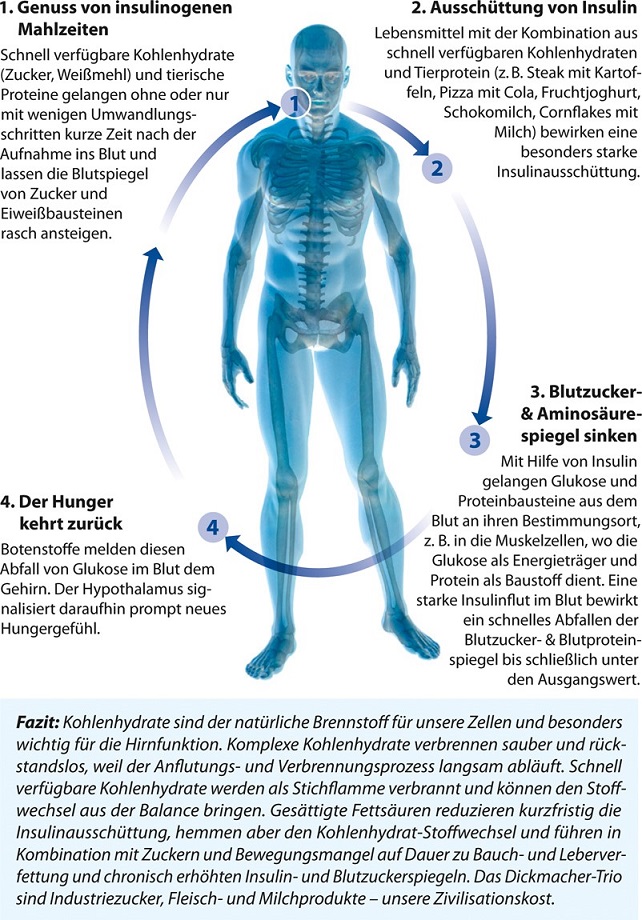
Unsere Nahrungsmittel sind inzwischen vor allem Industrieprodukte, die häufig viele Kalorien, viel Zucker und/oder Salz, aber wenig Vitalstoffe (wie Mineralstoffe, Vitamine, Spurenelemente, sekundäre Pflanzenstoffe und Ballaststoffe) enthalten. Diese stark verarbeiteten und meist tierischen Lebensmittel führen zu einer konzentrierten und schnellen Nährstoffflut, die unseren Stoffwechsel überlastet. Für eine effektive Verarbeitung der Makronährstoffe fehlen zudem wichtige Mikronährstoffe (Vitalstoffe), so dass die Stoffwechselaktivität zudem zunehmend ineffektiv ist. Beispielsweise hemmt eine niedrige Kalium- und Magnesiumzufuhr den Zuckerstoffwechsel und begünstigt eine Insulinresistenz. Gering verarbeitete, pflanzliche Lebensmittel liefern dagegen viele Vitalstoffe, die zum Betrieb der Zelle extrem wichtig sind, und enthalten gleichzeitig wenig Kalorien und Schadstoffe.
Zusätzlich muss unser Stoffwechsel immer mehr in immer kürzerer Zeit leisten. Es werden nicht mehr drei Mahlzeiten am Tag verzehrt, sondern zwischendurch halten zahlreiche energiedichte Snacks und Getränke den Insulin- und Nährstoffspiegel dauerhaft hoch. Die Mitochondrien, die Zellkraftwerke unserer Körperzellen, sollen ohne Pause Nährstoffe verbrennen und Energie liefern. Auf die Nährstoffflut, insbesondere auf gesättigte Fettsäuren, bestimmte Aminosäuren und hohe Glukosespiegel, reagiert die Zelle mit der Notbremse „Insulinresistenz“. Die gemästete, verfettete Zelle reagiert dann nicht mehr auf das Insulinsignal und schützt sich so vor der weiteren Nährstoffüberladung.
Während die Mitochondrien mehr arbeiten, entsteht auch vermehrt oxidativer und nitrosativer Stress, der in den Zellen zu strukturellen Schäden führt. Zusätzlich ist die Stoffwechselaktivität durch die Kombination von Nährstoffflut und Vitalstoffmangel überlastet. Der Stoffwechsel wird immer störanfälliger und erlahmt allmählich. Die mitochondriale Dysfunktion und oxidativer und nitrosativer Stress verursachen mit der Zeit eine Schädigung der Atmungskette und damit eine mitochondriale Zytopathie. Zusätzlich entsteht als Folge der Nährstoffflut eine endotheliale Dysfunktion, die langfristig zur Arteriosklerose führt.
Als Zivilisationsmenschen sind wir nicht von Hunger bedroht, sondern von „leeren Kalorien“: Die Belastung des Gehirns und des Nervensystems ist heutzutage höher als die der Muskeln. Daher benötigen wir Nahrung mit einer hohen Vitalstoffdichte und einer niedrigen Energiedichte.
Für den Blutdruck und den Stoffwechsel haben die Natrium-Kalium- und die Säure-Basen-Balance eine zentrale Bedeutung. Beim chronisch gestressten Zivilisationsmenschen sind basisch wirkende Kalium-, Magnesium- und Calciumverbindungen sowie eine geringe Natriumchlorid-Aufnahme insbesondere für den Blutdruck, den Herzmuskel und das Nervensystem sehr wichtig. Zu viel Salz fördert nicht nur Bluthochdruck, sondern auch die Insulinresistenz und die Krebsentstehung und steigert das Risiko für Schlaganfall und Herzinfarkt.
Ein funktionierender Stoffwechsel zeichnet sich durch ein harmonisches Fließgleichgewicht aus. Dabei kommt es auf das Zusammenspiel und die richtige Geschwindigkeit an. Zu viele „leere“, d.h. vitalstoffarme und schnell resorbierbare, energiedichte Kohlenhydrate wie Zucker und Weißmehl in Kombination mit tierischem Protein führen zu einer Hyperinsulinämie, während gesättigte Fettsäuren, die insbesondere in Fleisch- und Milchprodukten vorkommen, die Insulinresistenz fördern.
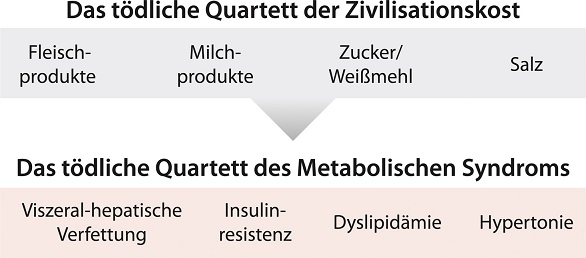
Die Folgen der modernen Zivilisationsernährung
Maß und Mitte gehen in unserer Ernährung und Lebensweise immer mehr verloren. Die Nationale Verzehrsstudie II (MRI, 2008) spiegelt dies mit den Zahlen zum Übergewicht in Deutschland wider: 58 % der Studienteilnehmer wiegen zu viel – 37 % sind übergewichtig und 21 % adipös, also fettleibig. Die nächste krankhafte Stufe ist das Metabolische Syndrom, auch Syndrom X genannt. Das Metabolische Syndrom wird folgendermaßen definiert:
Diagnose-Kriterien für das Metabolische Syndrom (Moebus et al., 2008):
- Abdominale Adipositas: Taillen-/Bauchumfang > 102 cm bei Männern bzw. > 88 cm bei Frauen
- Blutdruck ≥ 130/85 mmHg
- Nüchternglukose ≥ 5,6 mmol/l (100 mg/dl)
oder ein Gelegenheitszucker ≥ 11,1 mmol/l (200 mg/dl)
oder ein bekannter Diabetes mellitus Typ 2 - Triglyzeride ≥ 1,7 mmol/l (150 mg/dl)
- HDL-Cholesterin ≤ 1,03 mmol/l (40 mg/dl) bei Männern bzw. ≤ 1,29 mmol/l (50 mg/dl) bei Frauen
Die Diagnose Metabolisches Syndrom wird gestellt, wenn mindestens drei der fünf Kriterien erfüllt sind.
In den USA erfüllen bereits 32-40 % der Bevölkerung diese Kriterien. In Deutschland lag die Häufigkeit des Metabolischen Syndroms im Jahr 2008 laut der GEMCAS-Studie (German Metabolic and Cardiovascular Risk Project) bei 19,8 %. Bei Männern (22,7 %) tritt das Syndrom häufiger auf als bei Frauen (18,0 %). Im Alter zwischen 50 und 70 Jahren erfüllen bis zu 40 % die Definitionskriterien (Moebus et al., 2008).
Die International Diabetes Federation und die WHO sehen bei Männern europäischer Herkunft bereits ab einem Taillenumfang von 94 cm und bei Frauen von 80 cm eine abdominale Adipositas und damit ein wesentliches Kriterium des Metabolischen Syndroms erfüllt (Alberti et al., 2005; Alberti et al., 2009). Nach diesen Kriterien ist die Prävalenz auch in Deutschland noch deutlich höher und beträgt bei deutschen Männern sogar 40 %.
Gefahren des Metabolischen Syndroms
Das Metabolische Syndrom, das sich aus den oben genannten kardiovaskulären Risikofaktoren zusammensetzt, führt deutlich vermehrt zu Herz-Kreislauf-Erkrankungen und Diabetes mellitus Typ 2, begünstigt aber auch die Entwicklung einer Alzheimer-Demenz (de la Monte, 2012) sowie von Krebserkrankungen. Das Metabolische Syndrom ist assoziiert mit einer chronischen Entzündung, die durch hohe Zytokinspiegel, erhöhte Akute-Phase-Proteine und eine Aktivierung proinflammatorischer Signalwege charakterisiert ist. Das Fettgewebe in Leber und Bauch ist an der Entstehung dieser chronischen Entzündungsreaktion maßgeblich beteiligt.
Die stammbetonte Adipositas („Apfel-Form“) mit einem Taille-Hüft-Quotienten (Waist-Hip-Ratio) von über 0,85 bei Frauen und über 1 bei Männern ist Ausdruck der viszeralen Fettansammlung am Bauch. Eine viszerale Adipositas erhöht dramatisch das Risiko für Diabetes mellitus Typ 2, Herz-Kreislauf-Erkrankungen und Herzinfarkt und lässt sich über den Taille-Hüft-Quotienten am sichersten erfassen. Dies wurde in einer im Jahr 2005 in der Fachzeitschrift Lancet veröffentlichten, standardisierten Fallkontrollstudie mit 27.000 Teilnehmern aus 52 Ländern bestätigt (Yusuf et al., 2005).
Das Metabolische Syndrom entwickelt sich über die Jahre schleichend auf der Grundlage von Überernährung (zu viel Fett, tierisches Protein, Kohlenhydrate mit hohem Glykämischem Index sowie Fruktose) und Bewegungsmangel. Vorzeichen sind ein langsam wachsender Taillenumfang und Bauch, sich allmählich erhöhende Blutfett- und LDL-Cholesterin-Werte, relativ niedriges HDL-Cholesterin, ein erhöhter Ruhepuls und/oder dezent erhöhter Blutdruck. Im Hintergrund verlaufen unbemerkt die zunehmende Verfettung der Leber und eine Hyperinsulinämie – erhöhte Insulinwerte im Blut. Die Verfettung der Leberzellen führt auf zwei Wegen zur Hyperinsulinämie – zum einen mittels der sich entwickelnden Insulinresistenz, zum anderen in Folge der verminderten Insulin-Clearance aus dem Blut.
Das tödliche Quartett aus abdominaler Fettleibigkeit, Insulinresistenz, erhöhten Blutfettwerten und Bluthochdruck hat seine Entsprechung in einer Ernährung auf Basis der vier Grundzutaten der Zivilisationskost als alimentäres tödliches Quartett: Fleisch- und Milchprodukte, Zucker und Salz plus Bewegungsarmut.
Suchtmittel Insulin
Eine Insulinresistenz führt dazu, dass zwar die Körperzellen gegenüber der blutzuckerregulierenden Insulinwirkung resistent werden, jedoch die Hyperinsulinämie die anderen Insulinwirkungen noch verstärkt: Insulin wirkt stark anabol und fördert damit nicht nur Fettstoffwechselstörungen und Adipositas, sondern auch die Krebsentstehung.
Insulin erhöht die Cholesterinsynthese, den Sympathikotonus (Puls- und Blutdruckerhöhung) und den Tryptophanspiegel im Gehirn, was die Synthese von Serotonin und Melatonin fördern kann. Auch der direkte Einfluss von Insulin auf das dopaminerge Belohnungs- und damit auch Suchtsystem des Gehirns ist nachgewiesen. Doch dies funktioniert nur gut in einem natürlichen Rahmen und mit natürlichen Ruhepausen. Jedes Glück hat seinen Preis. Eine künstliche Erhöhung der Insulinpegel führt zur Herabregulation der Insulinrezeptoren – die Dosis muss steigen, um den gleichen Effekt zu erreichen.
Das Motto der heutigen Ernährungsweise würde Hippokrates wohl so bezeichnen: „Eure Suchtmittel sind Eure Lebensmittel.“ Diese Zusammenhänge erklären, warum Abnehmen bei einer Hyperinsulinämie ein ähnlich schweres Unterfangen ist wie ein Entzug bei einer Suchterkrankung. Sowohl im Rahmen einer Krebstherapie und -prävention als auch im Rahmen des gesunden Alterns gilt es somit, eine Insulinresistenz und die damit verbundene Hyperinsulinämie und erhöhte IGF-Spiegel zu vermeiden bzw. rückgängig zu machen. Welche Faktoren zu einer Insulinresistenz und Hyperinsulinämie führen, erfahren Sie im Folgenden.
Bewertung von Lebensmitteln: Food-Insulin-Index schlägt Glykämischen Index
Der Glykämische Index (GI) beschreibt die Blutzuckerwirkung des Kohlenhydratanteils eines Lebensmittels innerhalb der ersten zwei Stunden nach Verzehr. Dabei ist er wenig praxisgerecht, denn er beschreibt die Blutzuckerreaktion auf die Zufuhr von 100 g Kohlenhydraten, die über ein bestimmtes Lebensmittel zugeführt werden, und nicht die Reaktion auf 100 g des Lebensmittels. Weißbrot und gekochte Möhren haben den gleichen GI, doch die Aufnahme von 104 g Baguettebrot führt zu demselben Blutzuckeranstieg wie die Aufnahme von 800 g gekochten Möhren. Der Glykämische Index ist individuell relativ variabel und daher mehr ein Indikator als eine feste wissenschaftliche Größe (Vega-López et al., 2007).
Die Glykämische Last (GL) ist das Produkt des GI und der verwertbaren Kohlenhydratmenge (in Gramm) pro Portion eines Lebensmittels, geteilt durch 100. Damit ist sie ein guter Indikator der glykämischen Antwort auf eine Lebensmittelportion.
Auch wenn GI und GL wertvolle Indikatoren sind, werden sie in den Medien und in der populärwissenschaftlichen Literatur überbewertet und führen zu einer eindimensionalen, einseitigen Beurteilung von Lebensmitteln. Deutlich ausschlaggebender für die Pathogenese chronischer Erkrankungen ist die Insulinreaktion auf Lebensmittel. Der Food-Insulin-Index (FII) beschreibt die Auswirkung verschiedener Lebensmittel auf den Insulinspiegel und berücksichtigt damit auch die Wirkung von Proteinen. Der Zusammenhang von Proteinaufnahme und Insulinanstieg ist in Deutschland weitgehend unbekannt. Dabei liegt dieser Zusammenhang aus physiologischer Sicht auf der Hand, denn Insulin ist nicht nur für die Aufnahme von Zucker in die Zelle wichtig, sondern auch für die Aufnahme von Aminosäuren. Ähnlich wie bei Kohlenhydraten gibt es schnell und weniger schnell im Blut anflutende Proteine. Tierisches Protein aus Milchprodukten gehört zu den „schnellen“ Proteinen, die auch einen besonders hohen Insulinanstieg auslösen. Denn tierisches Protein aus Milch und Fleisch enthält reichlich Glutamin und Leucin, die eine hohe Insulinausschüttung (Li et al., 2004) und eine starke IGF-1-(Insulin-like growth factor 1)Antwort auslösen.
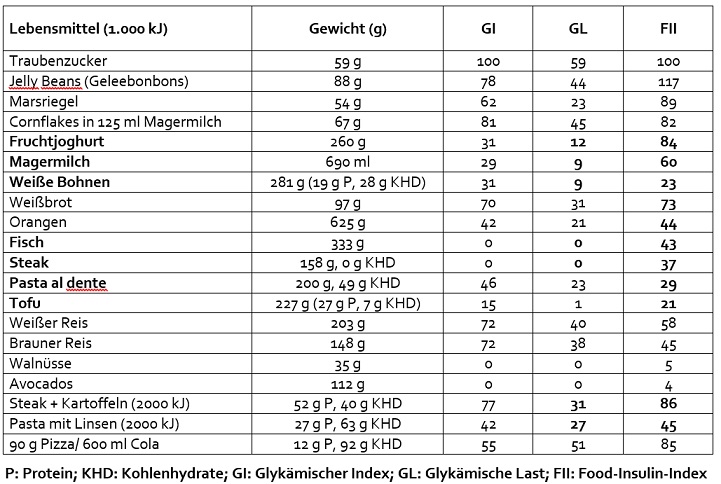
Steak setzt 27 % mehr Insulin frei als Pasta
Die bisher umfangreichste Untersuchung (Bao et al., 2011) des Effekts von Lebensmitteln auf die Insulin-sekretion (Food-Insulin-Index, FII) ergab, dass der Kohlenhydratgehalt und der Glykämische Index (GI) nur die Insulinausschüttung für kohlenhydratreiche Nahrungs¬mittel vorhersagen konnten. Auch die Glykämische Last erklärte nur weniger als die Hälfte der erreichten Insulinblutwerte. Der FII ist das Ergebnis der Arbeitsgruppe um Jennie Brand-Miller, einer der führenden GI-Forscherinnen der Welt. Als Referenz für den FII dienen 1.000 kJ Traubenzucker (59 g) mit einem FII von 100 (s. Tabelle). 1.000 kJ Weißbrot (97 g) erreichen einen FII von 73. Dass Weißbrot nicht gesund ist, ist nichts Neues. Dass aber 1.000 kJ (333 g) Fisch (FII 43) und 1.000 kJ (158 g) Steak (FII 37) zu einer wesentlich höheren Insulinausschüttung als 1.000 kJ (200 g) Pasta (FII 29) führen, erklärt die für europäische Verhältnisse schlanke Linie der Italiener und zeigt die Gefahr der heutigen populärwissenschaftlichen Ernährungsratschläge. Wer nun aber 227 g Tofu isst, nimmt auch 1.000 kJ und 27 g Protein auf, hat aber eine wesentlich niedrigere Insulinausschüttung (FII 21).
Für Frauen, deren Hauptproteinquelle Milchprodukte sind, birgt der FII besondere Überraschungen. 1.000 kJ gesüßter Joghurt (260 g) erreichen einen FII von 84, entrahmte Milch (1.000 kJ/690 g) einen FII von 60. Damit verursachen 1.000 kJ Magermilch im Vergleich zu 1.000 kJ weißen Bohnen fast die dreifache Insulinausschüttung – bei gleicher Glykämischer Last. Ein Glas Milch zur Pasta al dente macht somit die niedrige Insulinwirkung der Pasta mehr als zunichte. Eine Portion von 59 g Käse enthält zwar nur einen FII von 33, aber gleichzeitig sehr viele gesättigte Fette, die eine Insulinresistenz fördern können, und genauso viel Energie (1.000 kJ) wie 625 g Orangen (FII 44).
Besonders hohe Insulinausschüttungen provoziert die Kombination von schnell verfügbaren Kohlenhydraten mit Protein, insbesondere aus Milch und Rindfleisch. Besonders bemerkenswert ist auch: Pasta mit Linsen (2.000 kJ) liefern zwar 27 g Protein und 63 g Kohlenhydrate, haben aber einen FII von nur 45. Dagegen erreichen Steak mit Kartoffeln (auch 2.000 kJ) mit nur 40 g Kohlenhydraten und 52 g Protein einen fast doppelt so hohen FII von 88 (Bao et al., 2011; s. Tabelle). Alle Werte der Studie wurden mit gesunden, schlanken Probanden ermittelt, bei Personen mit Insulinresistenz liegt die Insulinausschüttung noch deutlich höher.
Vergleich des Food-Insulin-Index (FII) einiger Lebensmittel in Bezug auf 1.000 Kilojoule (kJ)
Nicht nur schnell verfügbare Kohlenhydrate, sondern insbesondere auch tierisches Protein führt also zu einer hohen Insulinausschüttung. Der insulinogene Effekt von Fleisch ist bei nicht-insulinpflichtigen Diabetikern so groß, dass durch den Verzehr von 50 g Fleischprotein die Insulinspiegel so sehr erhöht werden wie durch 50 g Glukose (Nuttall et al., 1984). Glukose in Kombination mit Hüttenkäse erhöhte bei Diabetikern die Gesamt-Insulinausschüttung um das 3,6-Fache (Gannon et al., 1988). Diese Ergebnisse so zu interpretieren, dass tierisches Protein dem Diabetiker hilft, Insulinspiegel zu regenerieren, ist nicht kausal gedacht. Krankheitsursache sind Insulinresistenz und Hyperinsulinämie.
Während Fett bei Gesunden die Insulinsekretion zu reduzieren scheint, trifft dies offenbar auf Diabetiker nicht mehr zu. Die Zugabe von Butter zu Kartoffeln führt zwar bei Gesunden zu einer Reduktion des Blutzuckeranstiegs, jedoch zur gleichen Insulinantwort wie bei der Aufnahme von Kartoffeln ohne Butter (Ercan et al., 1994). Bei nicht-insulinpflichtigen Diabetikern erhöht die Butter hingegen sowohl den Blutzuckerspiegel als auch die Insulinantwort (Gannon et al., 1993).
Sündenbock Kohlenhydrate – Verursacher von Stoffwechselerkrankungen sind tierisches Protein und gesättigte Fettsäuren
Fälschlicherweise werden Kohlenhydrate für die Insulinresistenz, Hyperinsulinämie und deren Endstadium Diabetes mellitus Typ 2 verantwortlich gemacht. Diese spielen jedoch im Vergleich zu tierischem Protein und gesättigten Fettsäuren eine stark untergeordnete Rolle. In der EPIC-Studie mit 38.094 niederländischen Teilnehmern (Sluijs et al., 2010) wurden in einem Follow-up von 10 Jahren die Risiken einer Diabetes-Erkrankung bestimmt: Tierisches Protein führte zu einem 118 % höheren Risiko (höchstes vs. niedrigstes Quartil), pflanzliches Protein zeigte keine Korrelation. Dagegen führte eine hohe glykämische Last nur zu einer Risikoerhöhung für Diabetes um 27 % und hohe GI-Werte zu einer Risikoerhöhung um 8 %. Kohlenhydrate erhöhten das Risiko um 15 %, Stärke um 25 %. Ballaststoffe senkten das Risiko um 8 %.
Auch in einer großen Metaanalyse der Harvard School of Public Health mit insgesamt 442.101 Teilnehmern erhöhte rotes Fleisch das Diabetes-Risiko am stärksten (Pan et al., 2011). Selbst nachdem bekannte Risikofaktoren (Alter, BMI und andere Lebensstil- und Ernährungsfaktoren) statistisch berücksichtigt worden waren, führten täglich 100 g rotes, unverarbeitetes Fleisch zu einem 19 % höheren Risiko. Nur 50 g verarbeitetes Fleisch täglich wie z. B. Wurst oder Hamburger erhöhten das Risiko sogar um 51 %. Wer dagegen verarbeitetes Fleisch durch Nüsse ersetzte, senkte sein Diabetes-Risiko um 32 %, wer es durch Vollkornprodukte ersetzte um 35 %.
In der großen Adventist Health Study 2 mit fast 100.000 Teilnehmern nahmen Veganer im Schnitt mehr Kalorien auf als Nicht-Vegetarier (1897 vs. 1884 kcal). Dennoch hatten sie einen viel niedrigeren BMI (24,1) als die Nicht-Vegetarier (28,3) (Orlich et al., 2013) und das Diabetesrisiko der Nicht-Vegetarier war vierfach so hoch wie das der reinen Pflanzenköstler (Tonstad et al., 2013). Dies unterstützt die epidemiologischen und biochemischen Erkenntnisse, dass vor allem tierische Lebensmittel zu Übergewicht und Stoffwechsel-Erkrankungen führen.
Hier geht es zum zweiten Teil des Artikels. Dieser thematisiert weitere zentrale Ursachen der Insulinresistenz, darunter die Entstehung der Fettleber als zentrales Element in der Entwicklung aller Stoffwechselerkrankungen.




